
- •Методы аналитической химии
- •Теоретические основы аналитической химии
- •2.1. Общая характеристика реакций в растворе
- •2.2. Кислотно-основные равновесия
- •2.2.1. Растворы сильных кислот и оснований
- •2.2.2. Растворы слабых кислот и оснований
- •2.2.3. Буферные системы
- •2.3. Осаждение и растворение малорастворимых соединений
- •2.3.2. Расчет растворимости осадка
- •2.4. Реакции комплексообразования
- •2.5. Реакции окисления–восстановления
- •2.5.1. Окислительно–восстановительные потенциалы
- •25.2. Направление окислительно-восстанови-тельных процессов
- •3. Методы количественного анализа
- •3.1. Гравиметрический метод анализа
- •3.1.1. Образование осадков
- •3.1.2. Промывание осадков
- •3.1.3. Гравиметрическая форма
- •3.1.4. Расчеты в гравиметрическом анализе
- •3.2. Титриметрический анализ
- •3.2.1. Способы выражения концентрации растворов
- •3.2.2. Основные приемы титрования
- •3.3. Методы титриметрического анализа кислотно-основное титрование
- •3.3.1. Кривые титрования
- •3.3.2. Выбор индикатора
- •3.3.3. Расчеты в титриметрическом анализе
- •Окислительно-восстановительное титрование (редоксиметрия)
- •3.4.1. Перманганатометрия
- •Иодометрия
- •3.5. Титрование по методу осаждения
- •3.6. Комплексонометрическое титрование
3.3.2. Выбор индикатора
Кривые титрования позволяют проанализировать процесс титрования, установить скачок титрования, положение точки эквивалентности и подобрать необходимый индикатор, с помощью которого будет фиксироваться окончание реакции. Чем ближе интервал перехода окраски индикатора к рН точки эквивалентности, тем точнее она будет фиксироваться. При выборе индикатора следует руководствоваться следующими правилами:
значение рТ индикатора должно быть близко к значению рН в точке эквивалентности;
величина интервала перехода окраски индикатора должна полностью или частично входить в пределы скачка титрования.
Если интервал перехода индикатора нанести на кривую титрования, то можно легко определить области применения отдельных индикаторов. В рассматриваемом примере рисунок показывает, что интервалы перехода метилового оранжевого не перекрывается скачком титрования уксусной кислоты и, следовательно, для данного титрования индикатор непригоден. Наиболее подходящим индикатором для уксусной кислоты является фенолфталеин, окрашивающий раствор в т.э. в пурпурный цвет.
Индикаторы, применяемые в кислотно-основном титровании сами являются слабыми кислотами или основаниями и при титровании часть стандартного раствора может быть израсходована на титрование индикатора. Поэтому всегда следует брать 1 – 2 капли индикатора, причем одно и то же количество при параллельных измерениях. На изменение окраски кислотно-основных индикаторов влияют присутствие нейтральных электролитов, растворители, температура. Можно сказать, что взаимодействие индикаторной системы с другими компонентами анализируемого раствора имеет сложный характер и определяется многими факторами. В результате возникают систематические погрешности титрования, основной из которых является несовпадение перехода окраски индикатора с концом реакции. Если изменение окраски произошло раньше, чем вещества прореагировали в эквивалентных количествах, то раствор будет недотитрован и результат анализа занижен. Если индикатор меняет окраску после точки эквивалентности, то раствор будет перетитрован, а результат анализа занижен. Погрешности такого рода называют индикаторными.
Пример: Определить величину погрешности при титровании 0,1 М раствора уксусной кислоты 0,1 М раствором NaOH при использовании индикаторов:
а). метилового оранжевого;
б). фенолфталеина.
Решение: В точке эквивалентности рН 8,73:
а) титрование с метиловым оранжевым заканчивается при рН 4 (справочные данные), т.е. до точки эквивалентности, следовательно, в растворе присутствуют недотитрованные молекулы СН3СООН и будет иметь место кислотная ошибка титрования, которая вычисляется по формуле:
∆ НА=
![]() .100
=
.100
=
![]() .
100 = 85 %
.
100 = 85 %
Погрешность очень велика, применить метиловый оранжевый при титровании уксусной кислоты нельзя.
б) показатель титрования фенолфталеина рТ 9, т.е после точки эквивалентности, поэтому раствор будет немного перетитрован (погрешность гидроксильная).
∆ОН =
![]() .
100 = +0,02 %
.
100 = +0,02 %
Погрешность мала, следовательно, индикатор пригоден для титрования.
3.3.3. Расчеты в титриметрическом анализе
Расчет результатов титриметрического анализа основан на принципе эквивалентности, согласно которому вещества реагируют между собой в количествах пропорциональных их эквивалентам.
Если известны объем раствора вещества (VB), израсходованный на титрование; нормальная концентрация вещества сн (А) и его объем (VA), то концентрацию вещества В можно найти из уравнения:
сн (А) VA = cн (В)VB
Масса определяемого вещества (mА) рассчитывается по известным объемам реагирующих веществ и известной нормальной концентрации одного вещества сн (В).
mА = cн(В) VB MA fэкв(А)
Если титруют не весь раствор (Vобщ.), а только часть его (аликвоту) — Vа, то масса рассчитывается по выражению:
mA =
![]() ,
,
где fэкв(А) — фактор эквивалентности определяемого вещества А, МА — его молярная масса, г/моль.
В серийных анализах при расчетах используют титр по определяемому веществу (ТВ/A), который показывает, с какой массой определяемого вещества реагирует 1 см3 стандартного раствора (В), тогда результат анализа рассчитывается:
mА = ТВ/А . VВ
Часто в расчетах используют поправочный коэффициент К, показывающий ,во сколько раз практическая нормальная концентрация больше или меньше концентрации стандартного раствора.
Пример 1: Навеску хлорида натрия массой 1,4987 г растворили в мерной колбе вместимостью 250 мл. На титрование 20,00 мл этого раствора пошло 20,20 мл 0,1 М раствора нитрата серебра (К = 0,98). Найти массовую долю (%) примеси в образце.
Решение: Определение относится к прямому титрованию. Масса NaCl в образце рассчитывается по уравнению:
m NaCl
=
![]() = 1,4476 г
= 1,4476 г
Примеси будут составлять 1,4987 – 1,4476 = 0,0511 г
ω = 3,41 %
Пример 2: Какую навеску NaOH следует взять, чтобы на титрование ее расходовалось 22,00 мл раствора HCl (ТHCl/NaOH = 0,005682 г/мл?
Решение: mNaOH = ТHCl / NaOH . VNaOH = 0,005682 . 22,0 = 0,1250 г.
Пример 3: Навеска мрамора в 0,2834 г растворена в 30,00 мл 0,3933 Н раствора HCl. На титрование избытка кислоты израсходовано 14,10 мл 0,4409 Н раствора NaOH. Вычислить массовую долю (%) СаСО3 в образце.
Решение. Определение относится к обратному титрованию.
Определяем объем раствора HCl, пошедший на взаимодействие с NaOH:
VHCl =
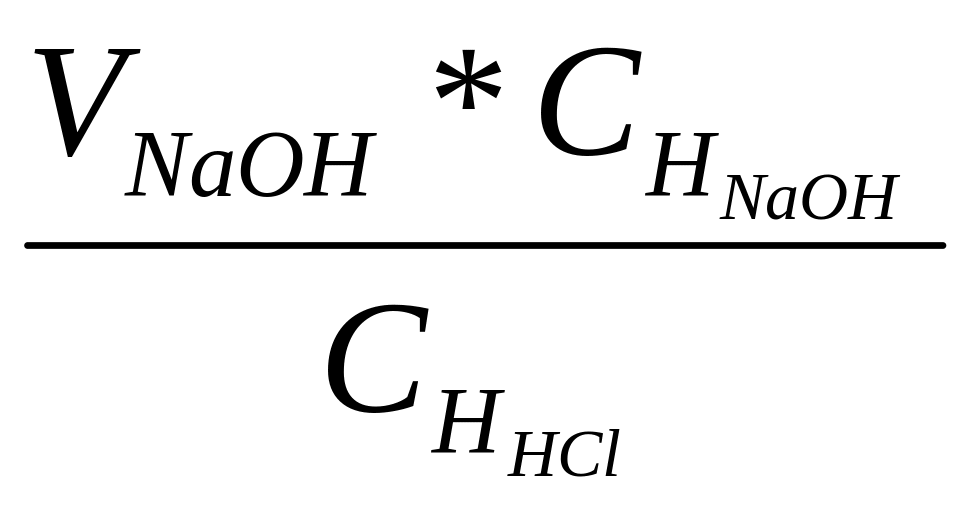 =
=
![]() = 15,81 мл
= 15,81 мл
Следовательно, на взаимодействие с СаСО3 пойдет 30,00 — 15,81 = 14,19 мл
М (СаСО3) = 100,09 г/моль
mСаСО = 0,001 . сHCl . VHCl . М (СаСО3) . fэкв.(СаСО3) = 0,001 . 0,3933 . 14,19 . 100,09 . ½ = 0,2790 г
ω = 0,2790*100/0,2834 = 98,44 %
