
- •Методы аналитической химии
- •Теоретические основы аналитической химии
- •2.1. Общая характеристика реакций в растворе
- •2.2. Кислотно-основные равновесия
- •2.2.1. Растворы сильных кислот и оснований
- •2.2.2. Растворы слабых кислот и оснований
- •2.2.3. Буферные системы
- •2.3. Осаждение и растворение малорастворимых соединений
- •2.3.2. Расчет растворимости осадка
- •2.4. Реакции комплексообразования
- •2.5. Реакции окисления–восстановления
- •2.5.1. Окислительно–восстановительные потенциалы
- •25.2. Направление окислительно-восстанови-тельных процессов
- •3. Методы количественного анализа
- •3.1. Гравиметрический метод анализа
- •3.1.1. Образование осадков
- •3.1.2. Промывание осадков
- •3.1.3. Гравиметрическая форма
- •3.1.4. Расчеты в гравиметрическом анализе
- •3.2. Титриметрический анализ
- •3.2.1. Способы выражения концентрации растворов
- •3.2.2. Основные приемы титрования
- •3.3. Методы титриметрического анализа кислотно-основное титрование
- •3.3.1. Кривые титрования
- •3.3.2. Выбор индикатора
- •3.3.3. Расчеты в титриметрическом анализе
- •Окислительно-восстановительное титрование (редоксиметрия)
- •3.4.1. Перманганатометрия
- •Иодометрия
- •3.5. Титрование по методу осаждения
- •3.6. Комплексонометрическое титрование
2.4. Реакции комплексообразования
Комплексные соединения имеют достаточно сложный состав. Они состоят из центрального иона (комплексообразователь) и окружающих его лигандов, в качестве которых могут быть заряженные или нейтральные неорганические или органические частицы, причем и комплексообразователь и лиганды способны к самостоятельному существованию в растворе.
Одной из характеристик комплексного соединения является координационное число, показывающее число атомов (молекул), непосредственно связанных с комплексообразователем.
Наиболее часто встречаются координационные числа шесть и четыре, реже два. Иногда бывают соединения с координационными числами три и пять.
В растворе комплексные ионы находятся в состоянии равновесия, которое зависит от характера растворенного вещества и природы растворителя. Комплекс–электролит в водном растворе диссоциирует на комплексный ион и ионы внешней сферы:
[Co(NH3)6] Cl3 = [Co(NH3)6]3+ + 3Cl-
Образующиеся комплексные ионы подвергаются вторичной диссоциации, которая протекает по типу слабых электролитов.
[Co(NH3)6] 3+ Co3+ + 6NH3
Применив закон действующих масс к образовавшейся равновесной системе, получим:
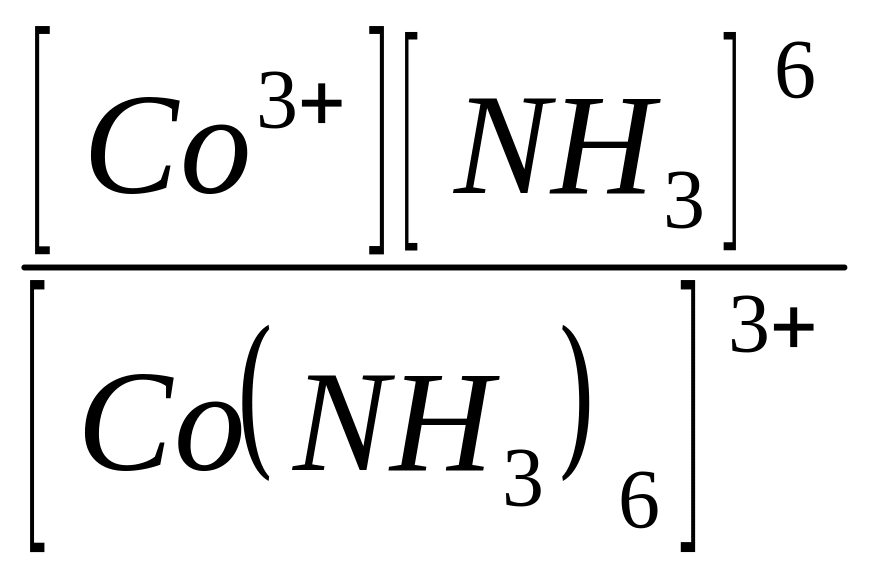 = К
= К
где К — константа нестойкости комплексного иона.
Пользуясь значениями константы нестойкости (табличные данные), можно определить молярные доли металла или лиганда, связанных в комплекс, а также отдельных комплексных частиц.
Пример. Вычислить концентрацию ионов Ag+ в растворе, содер-жащем 0,1 моль/дм3 K[Ag(CN)2]. Кнест. [Ag(CN)2]- = 1.10-21.
Кнест.=
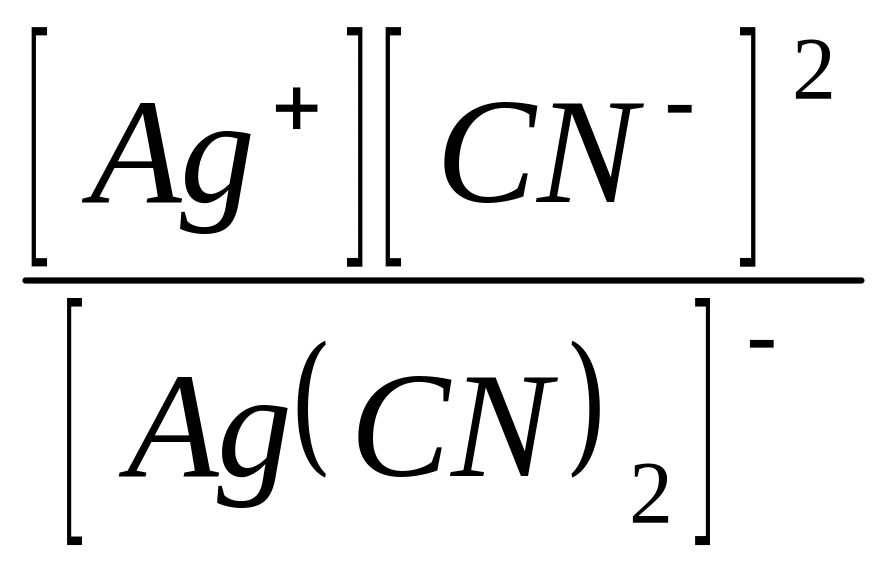 ,
,
Поскольку константа нестойкости мала, можно принять [Ag(CN)2]- = 0,1 моль/дм3, примем [Ag+] = х, тогда [CN-] = 2х.
Подставив найденные выражения в уравнение константы нестойкости, находим [Ag+]:
[Ag+] =
![]() = 6,3 . 10-8 моль/дм3
= 6,3 . 10-8 моль/дм3
2.5. Реакции окисления–восстановления
Характерной особенностью окислительно–восстановительных реакций является изменение степеней окисления реагирующих веществ вследствие переноса электронов от одного реагирующего вещества (восстановителя) к другому реагирующему веществу (окислителю). Процесс отдачи электронов называется окислением, присоединение их другим веществом — восстановлением. Каждую окислительно–восста-новительную реакцию можно представить как сумму двух олуреакций, одна из которых отражает процесс окисления, вторая – восстановления. Например: SnCl2 + 2FeCl3 SnCl4 + 2FeCl2
Sn2+ - 2e- Sn4+ (окисление)
Fe3+ + e- Fe2+ (восстановление)
При суммировании данных полуреакций необходимо предусмотреть, чтобы в соответствии с законом электронейтральности раствора число электронов, отдаваемых восстановителем, было точно равно числу электронов, принимаемых окислителем. На этом основан электронно–ионный метод подбора коэффициентов в окислительно-восста-новительных реакциях. Если в результате реакции происходит перестройка многоатомной частицы, для уравнивания числа атомов в уравнение полуреакции в качестве участника процесса могут быть введены ионы Н+, ОН- или молекулы воды. Если реакция происходит в кислой среде, в уравнение полуреакции включают ионы Н+, если в щелочной – ОН- - ионы.
Пример. Составить уравнение реакции окисления ионов Cr3+ в ионы CrO42- действием брома в щелочной среде.
Cr3+ + Br2 + OH- CrO42- + 2Br- + H2O
Восстановитель Cr3+ в результате реакции в щелочной среде превращается в ион CrO42-. Для образования CrO42- необходимы четыре иона О2- ,:которые образуются из ионов ОН-.
Cr3+ + 8OH- CrO42- + 4H2O + e-
Чтобы уравнять число зарядов в правую часть следует ввести 3 электрона.
Cr3+ + 8OH- = CrO42- + 4H2O + 3e- (окисление)
Составим уравнение полуреакции восстановления Br2:
Br2 + 2e- = 2Br- (восстановление)
Чтобы уравнять число отдаваемых и принимаемых электронов, коэффициенты полуреакции окисления необходимо умножить на 2, а полуреакции восстановления — на 3.
При суммировании получаем:
2 I Cr3+ + 8OH- = CrO42- + 4H2O +3e-
3 I Br2 + 2e- = 2Br-
2Cr3+ + 3Br2 + 16OH- = 2CrO42- + 6Br- + 8H2O
