
- •Ю.Б.Кузьма, я.Ф.Ломницька
- •Гравіметричний та титриметричний аналіз Для студентів хімічного факультету
- •1. Статистична обробка результатів аналізу
- •1.1. Виявлення сумнівного результату
- •1.2. Обробка результатів аналізу методами математичної статистики
- •1.3. Приклад обробки і порівняння даних двох методів визначення
- •2. Гравіметричний аналіз
- •2.1. Визначення Сульфуру у формі сульфату
- •2.2. Визначення Барію
- •2.3. Визначення Феруму
- •2.4. Визначення Ніколу
- •3. Титриметричний аналіз
- •Методика виконання робіт у титриметрії
- •3.2. Основні позначення та формули для обчислень у титриметрії
- •3.3. Протолітометрія (кислотно-основне титрування)
- •3.3.1. Визначення основ
- •Приготування розчину натрію тетраборату. Натрій тетраборат при зберіганні втрачає частину кристалізаційної води, тому перед приготуванням цю сіль потрібно перекристалізовувати.
- •3.3.2. Визначення кислот
- •3.4. Редоксиметрія (окисно-відновне титрування)
- •3.4.1. Перманганатометрія
- •3.4.2. Біхроматометрія
- •3.4.3. Йодометрія
- •3.5. Метод осадження
- •3.5.1. Аргентометрія
- •Стандартизація розчину калію тіоціанату.
- •3.5.2. Меркурометрія
- •3.6. Комплексонометрія
- •3.6.1. Визначення дво і тризарядних катіонів металів
- •3.6.2. Використання іонного обміну при визначенні Ніколу та Цинку з одного розчину
- •Список основної літератури
- •Список додаткової літератури
- •Гравіметричний та титриметричний аналіз
3.6. Комплексонометрія
Важлива роль комплексних сполук в аналітичній хімії зумовила швидкий розвиток хімії полідентатних реагентів. Найбільш цікавими і перспективними сполуками цього типу є комплексони, які утворюють з іонами багатьох металів розчинні у воді комплекси. Розділ титриметрії, в якому як титранти викорис-товують комплексони, одержав назву комплексонометрії (хелатометрії, іноді вживають термін “трилонометрія”). Найчастіше використовують етилендиамін-тетраацетатну кислоту (комплексон II). Вільна кислота малорозчинна у воді, тому застосовують її двозаміщену натрієву сіль (комплексон III, ЕДТА, або трилон Б). Повна формула комплексону III наведена нижче, скорочено її позначають H4Y:
H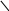
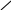 OOCH2C
CH2COOH
OOCH2C
CH2COOH
N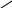
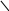 —CH2—CH2—N
—CH2—CH2—N
NaOOCH2C CH2COONa
Багато іонів металів здатні заміщувати атоми водню карбоксильних груп ЕДТА, одночасно зв’язуючись координаційно з нітрогеном аміногрупи. Вна-слідок цього утворюються дуже стійкі комплексні сполуки з кількома п’ятичленними кільцями. Будову комплексу двовалентного металу можна схематично зобразити формулою
—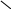
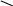

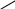 O—C—H2C
H2C
— CH2
CH2—C—O—
O—C—H2C
H2C
— CH2
CH2—C—O—
N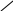

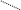
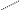 N
N
H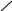

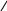
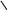 2C
Me
CH2
2C
Me
CH2
O==C — O O — C==O
Тривалентні метали замикають ще одне кільце з карбоксильною групою і т.д.
Залежно від кислотності розчину і порівняльної стійкості утворюваних комплексів з іоном металу може вступати в реакцію комплексоутворення молекулярна або одна з іонних форм ЕДТА: H4Y, H3Y-, H2Y2-, HY3-, Y4-, де Y аніон етилендиамінтетраацетатної кислоти. При цьому можуть утворюватися комплекси різного складу, наприклад Me(II)HY-, Me(II)Y2-, Me(III)HY-, Me(III)Y- і т.д. Важливим є те, що з найрізноманітнішими металами в різних умовах утворюються комплекси, в яких відношення металу до ліганда 1:1. Це відрізняє ЕДТА від більшості інших комплексоутворювачів.
У комплексонометрії кінцеву точку титрування визначають за допомогою металохромних індикаторів, а також специфічних речовин, які реагують з іонами певного металу (сульфосаліцилова кислота або тіоціанат на іон Fe3+).
Металохромні індикатори нестійкі у водних розчинах, тому їх застосо-вують у вигляді сухої суміші з натрій хлоридом у масовому співвідношенні 1:100. Механізм дії індикаторів полягає в тому, що вони при певному значенні кислотності утворюють з катіонами металів розчинні забарвлені комплекси, які у процесі титрування розчином ЕДТА руйнуються, а замість них утворюються безбарвні більш стійкі комплекси катіона з ЕДТА, отже, в точці еквівалентності спостерігається перехід забарвлення комплексу металіндикатора MeInd до забарвлення вільного індикатора (умовно H2Ind):
MeInd + H2Y2- MeY2- + H2Ind
забарвлення I забарвлення II.
Недоліком металохромних індикаторів є те, що вони виявляють кислотно-основні властивості. У результаті сам індикатор залежно від pH розчину існує в різних формах, кожна з яких має свій колір. Подаємо коротку інформацію про деякі металохромні індикатори.
Хромоген чорний, або еріохром чорний Т (натрієва сіль 1-окси-2-нафтил-азо-6-нітро-2-нафтол-4-сульфокислоти) у слабколужному розчині (pH 7-11) утворює винно-червоного кольору комплекси з катіонами Mg2+,Ca2+, Zn2+, Cd2+... Сам індикатор існує в трьох забарвлених формах: винно-червоний (pH<6), синій (pH 7-11), жовто-оранжевий (pH>11,5).
Мурексид
(амонійна сіль пурпурової
кислоти) утворює з іонами Ca2+,
Ni2+,
Co2+,
Cu2+
червоні або жовті комплекси, причому
склад їх залежить від pH
розчину. Наприклад, з іонами Zn2+
у слабколужному середовищі
існує комплекс ZnInd,
а в лужному
Zn(Ind)2.
Сам мурексид існує у трьох забарвлених
формах: червоно-фіолетовий (pH![]() 9),
фіолетовий (pH 9-10),
синьо-фіолетовий (pH
9),
фіолетовий (pH 9-10),
синьо-фіолетовий (pH![]() 11).
11).
Ксиленоловий оранжевий трифенілметановий барвник, який містить імінодіацетатні групи, характерні для всіх типових комплексантів. При pH 16 він утворює комплекси червоного кольору з іонами багатьох металів, а саме: Th(IV), Zr(IV), Sc3+, In3+, La3+, Pb2+, Cd2+, Hg2+. Іони Цирконію можна титрувати навіть у середовищі 12 М хлоридної або сульфатної кислоти. Ксиленоловий оранжевий існує у двох забарвлених формах: жовтий (pH 15), червоно-фіолетовий (pH 7).
На комплексонометричне титрування суттєво впливає середовище. У кислих розчинах (pH<3) утворюються менш стійкі комплексні сполуки. У слабкокислому середовищі титрують лише катіони, здатні утворювати з ЕДТА дуже стійкі комплекси, а саме: Fe3+, Th(IV), Zr(IV), Sc3+, In3+. При цьому інші катіони, які утворюють менш стійкі комплекси з комплексоном, не заважають визначенню. Зі збільшенням pH розчину більшість двозарядних іонів утворює стійкі комплекси. Однак у сильнолужному розчині при pH>10 спостерігається утворення комплексних оксисполук або осадів гідроксидів катіонів. Слід також мати на увазі, що у процесі утворення комплексу дослід-жуваного катіона з комплексоном виділяються іони гідроксонію і pH розчину зменшується. Щоб підтримувати сталим pH розчину, необхідно проводити титрування при наявності буферних сумішей. Більшість іонів Me2+ титрують у середовищі амонійної буферної суміші (розчин NH3 + NH4Cl) при pH 89. Це потрібно і для того, щоб металохромний індикатор був в одній із забарвлених форм. З метою маскування інших катіонів одночасно з буферною сумішшю у розчин вводять додатково комплексанти: тартрати, цитрати, фториди.
