
- •1. Коллекторские свойства горных пород
- •1.1 Классификация горных пород по происхождению
- •1.2 Гранулометрический состав пород
- •1.3 Пористость горных пород
- •1.4 Проницаемость горных пород
- •1.6 Распределение пор по размерам
- •1.7 Удельная поверхность
- •Нефте-, газо-, водонасыщенность горных пород
- •Методы определения количества остаточной воды
- •Влияние свойств поверхности на количество остаточной воды
- •Физико-механические свойства горных пород
- •Для упрощения формулы (6) и (7) запишем с другими постоянными в виде
- •Свойства пластовых жидкостей
- •1. Физическое состояние нефти и газа при различных условиях
- •Лекция 8 Растворимость газов в нефти
- •Давление насыщения нефти газом
- •Сжимаемость нефти. Объемный коэффициент
- •Плотность пластовой нефти
- •Вязкость пластовой нефти
- •Термодинамические свойства газов и нефтегазовых смесей
- •Лекция 10 Фазовые состояния углеводородных систем
- •Схемы фазовых превращений углеводородов
- •Схемы фазовых превращений однокомпонентных систем
- •Поведение бинарных и многокомпонентных систем в критической области
- •Влияние воды на фазовые превращения углеводородов
- •Фазовое состояние системы нефть - газ при различных давлениях и температурах
- •Расчет фазовых равновесий углеводородных смесей
- •Константы фазового равновесия
- •Определение давления схождения констант фазового равновесия углеводородных смесей
- •2. Зависимость поверхностного натяжения пластовых жидкостей от давления и температуры
- •3. Смачивание и краевой угол. Работа адгезии. Теплота смачивания.
- •4. Кинетический гистерезис смачивания.
- •5. Свойства поверхностных слоев
- •6. Методы измерения поверхностного натяжения
- •7. Методы измерения угла смачивания
- •Лекция 12
- •1. Источники пластовой энергии. Силы, действующие в залежи.
- •2. Поверхностные явления при фильтрации пластовых жидкостей. Причины нарушения закона Дарси.
- •3. Электрокинетические явления в пористых средах
- •4. Дроссельный эффект при движении жидкостей и газов в пористой среде
- •5. Общая схема вытеснения нефти водой и газом
- •6. Нефтеотдача пластов при различных условиях дренирования залежей
- •7. Роль капиллярных процессов при вытеснении нефти водой
- •8. Зависимость нефтеотдачи от скорости вытеснения нефти водой
- •9. Факторы, влияющие на нефтеотдачу пласта при использовании энергии газовой шапки и газа, выделяющегося из нефти
- •Повышение нефтеотдачи пластов
- •1. Методы увеличения извлекаемых запасов
- •2. Моющие и нефтевытесняющие свойства вод
- •3. Обработка воды поверхностно-активными веществами
- •4. Щелочное заводнение
- •5. Полимерное заводнение
- •6. Применение углекислоты для увеличения нефтеотдачи пластов
- •7. Термические способы увеличения нефтеотдачи
- •8. Вытеснение нефти из пласта растворителями
- •9. Вытеснение нефти газом высокого давления
- •Лекция 14 моделирование пластовых процессов
- •1. Использование лабораторных исследований
- •3. Условия подобия при моделировании двухфазной фильтрации
- •4. Приближенное моделирование
Расчет фазовых равновесий углеводородных смесей
Так как экспериментальный способ изучения газоконденсатных характеристик, являющийся основным для исследования фазовых превращений углеводородов, трудоемок и требует много времени большое внимание уделяется развитию расчетных методов оценки этих характеристик. Вследствие многообразия состава газоконденсатных систем, отдельные составляющие которых кипят в очень широком диапазоне температур, создать расчетные методы построения газоконденсатных характеристик очень сложно. Поэтому для прогнозирования фазовых превращений углеводородов при проектировании разработки газоконденсатных и газонефтяных месторождений и процессов переработки газа и конденсата используются приближенные методы расчета.
В основе расчетных методов оценки фазового состояния углеводородов лежит закон Дальтона-Рауля
![]() ,
(1)
,
(1)
где - общее давление смеси
и - мольные концентрации (доли) компонентов в паровой и жидкой фазах
![]() -
давление насыщения паров компонентов
смеси в чистом виде
-
давление насыщения паров компонентов
смеси в чистом виде
![]() -
парциальное давление компонента в
паровой фазе
-
парциальное давление компонента в
паровой фазе
![]() -
парциальное давление того же компонента
в жидкой фазе.
-
парциальное давление того же компонента
в жидкой фазе.
Из уравнения (1) следует, что распределение углеводородов между фазами двухфазной равновесной системы протекает в соответствии с давлением паров углеводородов и их мольными концентрациями. При нарушении равновесия в системе вследствие изменения температуры или давления начинается перераспределение углеводородов между фазами. Это происходит до тех пор, пока парциальные давления каждого компонента в газе и жидкости не сравняются. Углеводороды, имеющие при данной температуре давление насыщения паров большее, чем общее давление в системе, будут иметь и более высокую концентрацию в паровой фазе, чем в жидкой и наоборот. Используя закон Дальтона - Рауля и зная температуру и давление, при которых находится смесь, по концентрации компонента в одной из фаз можно найти ее концентрацию в другой фазе.
Давление паров жидкой смеси определяется как
![]() (2)
(2)
Концентрацию всех компонентов в равновесной паровой фазе определяют по уравнению
![]() (3)
(3)
Аналогичным образом можно определить состав жидкости, находящейся в контакте с газом, когда известен состав газовой смеси. Уравнения для расчетов в этом случае выглядят следующим образом:
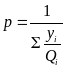 (4)
(4)
![]() (5)
(5)
Уравнение (2) называют уравнением начала однократного (контактного) испарения, а уравнение (4) - уравнением начала однократной конденсации.
Константы фазового равновесия
Константой
равновесия
![]() называют отношение концентрации данного
компонента в паровой фазе к его
концентрации в жидкой фазе
называют отношение концентрации данного
компонента в паровой фазе к его
концентрации в жидкой фазе
![]()
Если ввести константы равновесия в уравнения (1), (3) и (5) , то они примут вид:
![]()
![]()
![]()
Каждый компонент смеси (кроме метана) имеет два значения давления, при которых константы равновесия равны единице: при давлении насыщенных паров компонентов и в точке их схождения. Давление, соответствующее этой точке называется давлением схождения. Если диаграмма составлена при критической температуре, то давление схождения будет критическим. При других температурах схождение будет лишь кажущимся. Для многих нефтей кажущееся давление схождения при котором константы равновесия всех компонентов становятся равными единице, составляет 34,5-35 МПа. При низких давлениях и температурах константы равновесия углеводородов мало зависят от состава смеси.
