
- •Основы электрохимии и электрохимических технологий
- •Введение
- •Окислительно-восстановительные реакции.
- •Правила уравнивания окислительно-восстановительных реакций.
- •Порядок уравнивания окислительно-восстановительных реакций, т.Е. Приведение их в форму, обеспечивающую закон сохранения энергии (баланс массы и заряда).
- •Демонстрация переноса электронов в окислительно-восстановительных реакциях. Гальванический элемент.
- •Лекция 2. Законы Фарадея и скорость электрохимического процесса Выход по току. Применение закона Фарадея к расчету скорости обработки металлов.
- •Скорость электрохимической обработки
- •Электрохимический эквивалент сплава и практический электрохимический эквивалент.
- •Лекция 3. Равновесный потенциал электрода Электрод, ячейка. Напряжение электрода и ячейки. Равновесный потенциал. Виды равновесных потенциалов.
- •Равновесный потенциал.
- •Виды равновесных потенциалов.
- •Лекция 4. Основы теории электролитической диссоциации Равновесные явления в растворах электролитов. Теория электролитической диссоциации. Ион - дипольное и ион - ионное взаимодействие в электролитах.
- •Теория Дюбая – Гюккеля и ион - ионное взаимодействие в растворах электролитов.
- •Гидролиз солей.
- •Буферные растворы.
- •Ионные равновесия при растворении. Произведение растворимости.
- •Лекция 6 Электропроводность электролитов
- •Экспериментальное определение электропроводности.
- •Особые случаи электропроводности электролитов.
- •Электроды первого рода. Потенциал ионно-металлического электрода.
- •Электроды второго рода.
- •Хлорсеребряный электрод.
- •Окислительно – восстановительные (redox) системы.
- •Водородный электрод.
- •Хингидронный электрод.
- •Мембранный потенциал или потенциал Донана.
- •Методы изучения двойного электрического слоя.
- •Модельные представления о строении двойного электрического слоя.
- •Форма поляризационной кривой при наличии стадии массопереноса.
- •Лекция 11 Теория замедленного разряда.
- •Свойства уравнения теории замедленного разряда.
- •Лекция 12 Поляризация (перенапряжение) при образовании новой фазы. Перенапряжение при лимитирующей стадии образования двумерных и трёхмерных зародышей.
- •Перенапряжение поверхностной диффузии при электроосаждении металлов.
- •Перенапряжение образования пузырьков газа и связь размеров пузырьков с потенциалом.
- •Предельные токи при электроосаждении. Эффект м.А.Лошкарёва.
- •Электрические процессы в условиях медленной гомогенной химической реакции.
- •Критерии определения природы лимитирующейстадии.
- •Лекция 14 Примеры механизмов некоторых электрохимических реакций.
- •Примеры механизмов различных электрохимических реакций. Реакция выделения водорода (водородный электрод).
- •Кинетическая теория коррозии.
- •Коррозия при кислородной деполяризации.
- •Роль локальных элементов в возникновении коррозии и достижении её скорости.
- •Методы защиты от коррозии.
- •Пассивность металлов.
- •Электрохимическая размерная обработка металлов и сплавов
- •Основы прикладной электрохимии и электрохимических технологий Лекция 1 Основные особенности электрохимических технологий.
- •Конструктивные принципы электрохимических реакторов
- •Межэлектродный зазор
- •Токовые нагрузки
- •Сепараторы
- •Подвод и отвод компонентов реакции
- •Корректировка состава электролита
- •Масштабный фактор
- •Подбор коррозионностойких материалов
- •Экономические показатели
- •Классификация основных процессов переноса при химической и электрохимической технологии
- •Лекция 2. Распределение тока и рассеивающая способность электролитов Распределение тока. Виды распределения тока. Параметр Вагнера. Рассеивающая (локализующая) способность электролитов
- •Первичное распределение тока.
- •Вторичное распределение тока.
- •Третичное распределение тока.
- •Распределение тока при высоких плотностях тока (при наличии поверхностного тепловыделения)
- •Распределение скоростей осаждения или растворения при наличии зависимости выхода по току от плотности тока
- •Методы расчёта распределения тока.
- •Методы экспериментального определения рассеивающей (локализующей) способности электролита
- •Лекция 3. Химические источники тока (хит). Основные характеристики хит
- •Лекция 4 Первичные хит (хит первого рода, элементы)
- •Сухие марганцево-цинковые (мц) элементы
- •Первичные хит с магниевыми и литиевыми анодами
- •Первичные хит с литиевыми анодами
- •Хит с твердым электролитом
- •Лекция 5 Вторичные хит (аккумуляторы).
- •Свинцовые кислотные аккумуляторы
- •Основные неисправности свинцовых кислотных аккумуляторов.
- •Щелочные аккумуляторы
- •Лекция 6 Топливные элементы.
- •Лекция 7. Электролиз водных растворов без выделения металлов Производство водорода и кислорода
- •Производство тяжелой воды
- •Интенсификация электрохимических методов получения водорода
- •Лекция 8. Электрохимическое производство хлора, щелочи и гипохлотрта натрия
- •Теоретические основы электролиза растворов хлоридов
- •Электролиз с твердым катодом и фильтрующей диафрагмой
- •Электролиз с ртутным катодом.
- •Перспективы развития хлорной промышленности
- •Электросинтез гипохлорита натрия
- •Лекция 9 Электрохимические покрытия металлами и сплавами. Теоретические основы.
- •Два метода нанесения покрытий при электролизе
- •Назначение металлических покрытий металлами и сплавами
- •Управление свойствами и размерами покрытий
- •Использование нестационарного электролиза
- •Лекция 10 Электролитическое осаждение железа.
- •Катодный процесс при электроосаждении железа.
- •Электролиты железнения и режимы электролиза
- •Анодный процесс.
- •Лекция 11. Хромирование. Свойства и области применения хромовых покрытий
- •Некоторые особенности процесса хромирования
- •Электролиты и режимы электролиза.
- •Физико-механические свойства хромовых покрытий
- •Лекция 12. Меднение Область применения
- •Сравнительная характеристика медных электролитов.
- •Борфтористоводородные электролиты
- •Цианистые электролиты
- •Пирофосфатные электролиты
- •Лекция 13. Анодная и химическая обработка металлов Оксидирование
- •Электрохимическое и химическое полирование
- •Лекция 14. Электролиз расплавов. Общие сведения.
- •Строение расплавленных солей
- •Электропроводность расплавленных солей
- •Выход по току и удельный расход энергии при электролизе расплавов
- •Влияние физико-химических свойств электролита на процесс электролиза
- •Некоторые специфические явления при электролизе расплавов
- •Лекция 15. Производство алюминия
- •Переработка алюминиевых руд
- •Получение криолита
- •Электроды и другие материалы
- •Электролиз криолит-глиноземного расплава
- •Состав электролита
- •Конструкция и эксплуатация электролизеров
- •Рафинирование алюминия
- •Электролиз хлорида алюминия
- •Лекция 16. Гидроэлектрометаллургия
- •Лекция 17. Электролиз в металлургии благородных металлов
- •Вопросы для самопроверки, задачи и упражнения
- •Заключение Основные направления современного этапа развития электрохимии и электрохимических технологий
- •Литература
Коррозия при кислородной деполяризации.
Наиболее широко распространённой является коррозия в присутствии растворённого кислорода. Реакция восстановления кислорода имеет вид:
![]() (15.з)
(15.з)
Величина концентрации растворённого
кислорода в воде
![]() .
Поскольку эта концентрация очень низка,
на поляризационной кривой для реакции
(15.з) всегда будет наблюдаться предельный
диффузионный ток восстановления
кислорода.
.
Поскольку эта концентрация очень низка,
на поляризационной кривой для реакции
(15.з) всегда будет наблюдаться предельный
диффузионный ток восстановления
кислорода.
Рассмотрим коррозионную диаграмму для этого случая. Кривая катодного восстановления кислорода имеет несколько областей (рис. 15.3):
область А – зависимость скорости реакции восстановления растворенного кислорода от потенциала;
область В– предельный диффузионный ток восстановления кислорода (зависящий от скорости перемешивания (потока электролита));
область С– наблюдается при
более высоких катодных потенциалах и
соответствует реакции восстановления![]() до газообразного водорода.
до газообразного водорода.
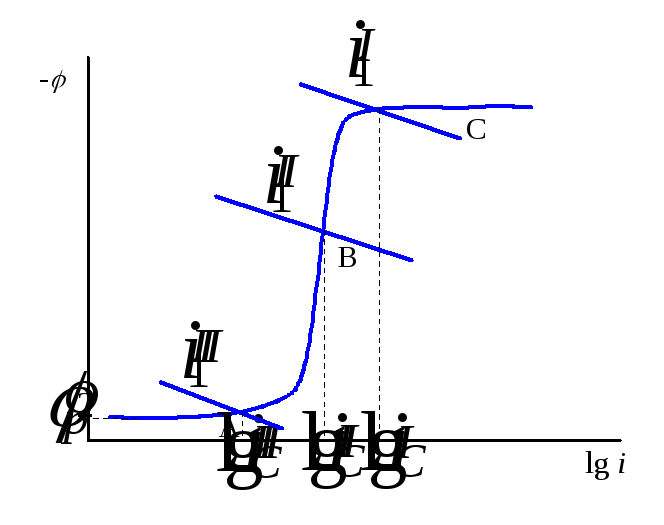
Рис. 15.3 Коррозионные диаграммы для коррозии с кислородной деполяризацией.
Можно себе представить, что для различных
металлов будут реализовываться различные
поляризационные кривые (зависимости
скорости анодного растворения от
потенциала
![]() ,
,![]() ,
,![]() ).
Равенство скоростей для металлаIдаст ток коррозии
).
Равенство скоростей для металлаIдаст ток коррозии![]() .
Совершенно очевидно, что это будет
коррозия с водородной деполяризацией,
поскольку областьС– это область
восстановления водорода. Несомненно,
что коррозия для металловIIиIIIбудет происходить с
кислородной деполяризацией и
подчиняться различным закономерностям.
Коррозия для металлаIIбудет существенно зависеть от скорости
перемешивания, поскольку областьВ
– это предельный диффузионный ток
восстановления кислорода, зависящий
от скорости перемешивания.
.
Совершенно очевидно, что это будет
коррозия с водородной деполяризацией,
поскольку областьС– это область
восстановления водорода. Несомненно,
что коррозия для металловIIиIIIбудет происходить с
кислородной деполяризацией и
подчиняться различным закономерностям.
Коррозия для металлаIIбудет существенно зависеть от скорости
перемешивания, поскольку областьВ
– это предельный диффузионный ток
восстановления кислорода, зависящий
от скорости перемешивания.
Плотность тока коррозии для металла IIIбудет:
меньше плотности тока коррозии с кислородной деполяризацией в области предельного диффузионного тока;
она не будет зависеть от скорости перемешивания.
Коррозия для металла IIиIIIназывается коррозией с кислородной деполяризацией, поскольку катодным процессом восстановления является восстановление растворенного кислорода (15.з). Общее условие коррозии можно выразить следующим образом:
![]() , (15.3)
, (15.3)
где
![]() -
равновесный потенциал восстановления
окислителя, а
-
равновесный потенциал восстановления
окислителя, а![]() - равновесный потенциал металла.
- равновесный потенциал металла.
Кинетическая теория коррозии позволяет не только объяснить достигаемую скорость коррозии, но и управлять ею, что показано выше в случае с кислородной деполяризацией.
Роль локальных элементов в возникновении коррозии и достижении её скорости.
Теория локальных элементов, разработанная Де ла Ривом, утверждала, что скорость коррозии зависит от наличия гальванических элементов на поверхности.
Предположим, что металлический цинк
содержит примесь меди и
![]() .Очевидно
(см. рис. 15.4), что цинк будет переходить
в раствор, а на меди будет выделяться
водород. Скорость его выделения на цинке
будет существенно меньше, чем на меди,
т.е. на поверхности металла возникает
гальванический элемент и начинает
протекать локальный ток, при этом
электроны будут переноситься от цинка
к меди. Потенциал цинка будет смещаться
в анодную область, усиливая его
растворение, а потенциал меди в катодную,
ускоряя выделение водорода на ней.
.Очевидно
(см. рис. 15.4), что цинк будет переходить
в раствор, а на меди будет выделяться
водород. Скорость его выделения на цинке
будет существенно меньше, чем на меди,
т.е. на поверхности металла возникает
гальванический элемент и начинает
протекать локальный ток, при этом
электроны будут переноситься от цинка
к меди. Потенциал цинка будет смещаться
в анодную область, усиливая его
растворение, а потенциал меди в катодную,
ускоряя выделение водорода на ней.

Рис. 15.4 Образование локальных элементов на поверхности корродирующего металла.
Это можно показать схематически с помощью коррозионной диаграммы.
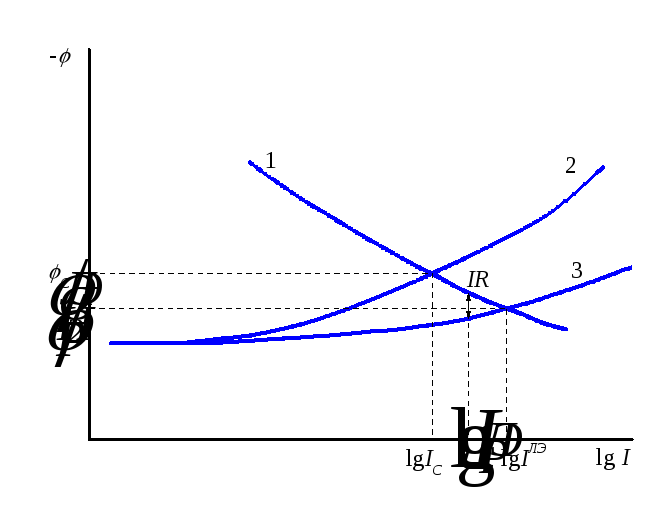
Рис. 15.5 Коррозионная диаграмма при наличии локального элемента. 1 – кривая анодного растворения металла. 2 – кривая выделения водорода на основном металле. 3 – это поляризационная кривая восстановления водорода на примеси.
Ток и потенциал коррозии для этого
случая будут соответствовать
![]() и
и![]() .
Ток коррозии на примеси будет существенно
ниже, поскольку меньше площадь поверхности
примеси, а, следовательно, перенапряжение
восстановления водорода на примеси
будет существенно ниже.
.
Ток коррозии на примеси будет существенно
ниже, поскольку меньше площадь поверхности
примеси, а, следовательно, перенапряжение
восстановления водорода на примеси
будет существенно ниже.
Очевидно, что ток локального элемента будет существенно выше, чем ток коррозии, а стационарный потенциал локального элемента существенно сместится в сторону анодных потенциалов.
Локальный ток элемента будет несколько
ниже, поскольку будет наблюдаться
некоторое омическое падение напряжения
(IR, рис. 15.5) внутри
обрабатываемого локального элемента.![]() .
.
Мы видим, что при наличии локальных элементов, т.е. наличии примеси в металле, скорость коррозии всегда будет повышаться по сравнению с чистым металлом. Но наличие локального элемента не является причиной возникновения коррозии. Коррозия технических металлов всегда будет выше, чем коррозия чистых металлов, но и для них она не будет нулевой. Наличие локального элемента в технических металлах является причиной увеличения скорости коррозии, но не является причиной её возникновения.
