
- •Часть 2. Коллоидная химия
- •Содержание
- •Введение
- •2. Коллоидная химия
- •2.1. Дисперсные системы
- •2.1.1. Структура дисперсных систем
- •Примеры решения задач и упражнений
- •Задачи и упражнения для самостоятельного решения
- •2.1.2. Классификация дисперсных систем
- •Задачи и упражнения для самостоятельного решения
- •2.1.3. Методы получения и очистки дисперсных систем
- •Конденсационные методы получения коллоидных систем
- •Химическая конденсация
- •Физическая конденсация
- •Диспергационные методы получения дисперсных систем
- •Методы очистки дисперсных систем
- •Примеры решения задач и упражнений
- •Задачи и упражнения для самостоятельного решения
- •2.2. Молекулярно-кинетические и оптические свойства коллоидных систем
- •2.2.1. Броуновское движение, диффузия, осмотическое давление. Их взаимосвязь
- •Примеры решения задач и упражнений
- •Задачи и упражнения для самостоятельного решения
- •2.2.2. Седиментация
- •Примеры решения задач и упражнений
- •Задачи и упражнения для самостоятельного решения
- •2.2.3. Рассеяние и поглощение света
- •Примеры решения задач и упражнений
- •Задачи и упражнения для самостоятельного решения
- •2.3. Строение и электрический заряд коллоидных частиц. Электрокинетические явления
- •2.3.1. Строение и электрический заряд коллоидных частиц
- •Примеры решения задач и упражнений
- •Задачи и упражнения для самостоятельного решения
- •2.3.2. Природа электрокинетических явлений
- •Примеры решения задач и упражнений
- •Задачи и упражнения для самостоятельного решения
- •2.4. Устойчивость и коагуляция коллоидных систем
- •2.4.1. Кинетическая и термодинамическая устойчивость коллоидных систем
- •Задачи и упражнения для самостоятельного решения
- •2.4.2. Гелеобразование (желатинирование)
- •Свойства гелей
- •Задачи и упражнения для самостоятельного решения
- •2.4.3. Теории коагуляции
- •1. Адсорбционная теория коагуляции г. Фрейндлиха
- •2. Электростатическая теория коагуляции г. Мюллера
- •3. Теория устойчивости гидрофобных дисперсных систем длфо
- •Примеры решения задач и упражнений
- •Задачи и упражнения для самостоятельного решения
- •2.5. Разные классы коллоидных систем
- •2.5.1. Аэрозоли и их свойства
- •Примеры решения задач и упражнений
- •Задачи и упражнения для самостоятельного решения
- •2.5.2. Порошки и их свойства
- •Примеры решения задач и упражнений
- •Задачи и упражнения для самостоятельного решения
- •2.5.3. Суспензии и их свойства
- •Примеры решения задач и упражнений
- •Задачи и упражнения для самостоятельного решения
- •2.5.4. Эмульсии и их свойства
- •Примеры решения задач и упражнений
- •Задачи и упражнения для самостоятельного решения
- •2.5.5. Пены и их свойства
- •2.5.6. Коллоидные системы, образованные поверхностно-активными веществами
- •Свойства коллоидных растворов пав
- •Примеры решения задач и упражнений
- •Задачи и упражнения для самостоятельного решения
- •2.5.7. Высокомолекулярные соединения (вмс) и их растворы
- •2.5.8. Полимерные полиэлектролиты
- •2.5.9. Набухание и растворение вмс
- •Примеры решения задач и упражнений
- •Задачи и упражнения для самостоятельного решения
- •2.5.10. Вязкость растворов вмс
- •Примеры решения задач и упражнений
- •Задачи и упражнения для самостоятельного решения
- •2.5.11. Осмотические свойства растворов вмс
- •Примеры решения задач и упражнений
- •Задачи и упражнения для самостоятельного решения
- •2.5.12. Факторы устойчивости растворов вмс
- •Предметный указатель
- •Приложение
- •1. Основные единицы измерения физических величин
- •2. Основные физические постоянные
- •Литература Основная
- •Дополнительная
Примеры решения задач и упражнений
1. Критическая концентрация мицеллообразования (ККМ) додецилсульфата натрия при 20, 40 и 60С составляет соответственно 1,5110–3; 1,6210–3 и 1,8710–3 моль/л. Рассчитайте стандартную теплоту, энергию Гиббса и энтропию мицеллообразования при 20С.
Решение:
Теплоту мицеллообразования q определяем по уравнению (0). Рассчитываем значения ln ККМ и 1/Т:
-
ln ККМ
– 6,50
– 6,42
– 6,28
1/Т
3,41
3,19
3,00
Строим график зависимости ln ККМ от 1/Т (рис. 44).
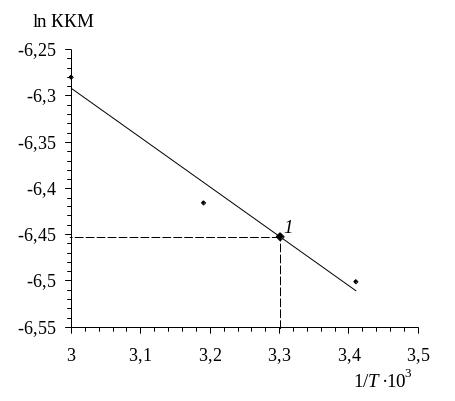
Рис. 44. Зависимость ln ККМ от 1/Т
Определяем теплоту мицеллообразования (0), используя координаты любой точки на прямой (См. Вводный блок. Основы математической обработки экспериментальных данных. 5. Расчет коэффициентов прямой):
![]()
отсюда
![]() кДж/моль.
кДж/моль.
Энергию Гиббса рассчитываем по уравнению (0):
![]()
Энтропию мицеллообразования находим, пользуясь термодинамическим уравнением (0):
![]()
2. Используя уравнение Дебая, рассчитайте мицеллярную массу ПАВ по следующим данным:
Концентрация раствора с, г/л |
0,5 |
1,0 |
1,5 |
2,0 |
4,0 |
Мутность раствора τ·109 см–1 |
2,00 |
2,88 |
3,54 |
3,85 |
5,09 |
Константа в уравнении Дебая H = 3·10–11; ККМ = 0,1 г/л; τККМ = 1,0·10–9 см–1.
Решение:
Составим таблицу для построения графика методом Дебая:
|
1,21 |
1,44 |
1,65 |
2,00 |
2,86 |
|
0,4 |
0,9 |
1,4 |
1,9 |
3,9 |
Строим график
зависимости
![]()
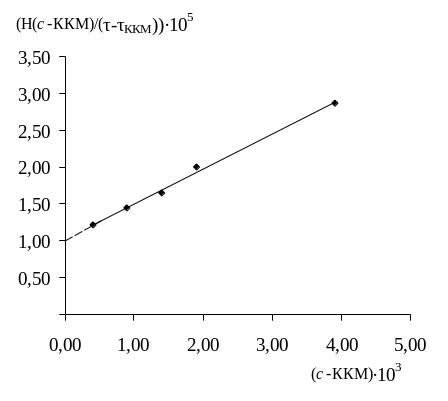
Рис. 45. Определение мицеллярной массы ПАВ методом Дебая
Согласно графику, ММ = 1·10–5 г.
Задачи и упражнения для самостоятельного решения
1. Рассчитайте теплоту мицеллообразования процесса при 293 К, энергию Гиббса и энтропию по следующим данным для додецилсульфата натрия в растворе NaCl:
-
Т, К
293
311
333
ККМ в 0,01 М растворе NaCl, ммоль/л
5,13
5,37
6,17
(Ответ: 2,702 кДж/моль; –12,844 кДж/моль; 34,6Дж/(мольК))
2. Рассчитайте теплоту мицеллообразования процесса при 293 К по следующим данным для додецилсульфата натрия в растворе NaCl:
Т, К |
293 |
311 |
333 |
ККМ в 0,2 М растворе NaCl, ммоль/л |
0,76 |
0,87 |
1,45 |
(Ответ: 12,24 кДж/моль; –17,490 кДж/моль; 17,92 Дж/(мольК))
3. Мыло образует в воде мицеллы, радиус которых равен 12,5 нм. Определите коэффициент диффузии мицелл при 313 К, если вязкость раствора равна 6,5·10–4 Па·с.
(Ответ: 2,8·10–11 м2/с)
4. Оцените поверхностную активность лаурилсульфата на границе его водного раствора с воздухом, если известно, что при ККМ, равной 0,015 моль/л, поверхностное натяжение составляет 30 мДж/м2. Пповерхностное натяжение воды 71,96 мДж/м2.
(Ответ: 1,69·10–5 моль/м2)
5. По уравнению Дебая рассчитайте мицеллярную массу полистирола, используя данные по измерению светорассеяния растворов полистирола в толуоле:
Концентрация раствора с, г/л |
0,6 |
1,1 |
1,6 |
2,1 |
3,3 |
Мутность раствора τ·109 см–1 |
2,10 |
2,63 |
3,05 |
3,46 |
5,61 |
Константа в уравнении Дебая H = 3·10–13; ККМ = 0,2 г/л; τККМ = 1,5·10–8 м–1
(Ответ: ММ = 1,8·10–5 г)
