
- •Часть 2. Коллоидная химия
- •Содержание
- •Введение
- •2. Коллоидная химия
- •2.1. Дисперсные системы
- •2.1.1. Структура дисперсных систем
- •Примеры решения задач и упражнений
- •Задачи и упражнения для самостоятельного решения
- •2.1.2. Классификация дисперсных систем
- •Задачи и упражнения для самостоятельного решения
- •2.1.3. Методы получения и очистки дисперсных систем
- •Конденсационные методы получения коллоидных систем
- •Химическая конденсация
- •Физическая конденсация
- •Диспергационные методы получения дисперсных систем
- •Методы очистки дисперсных систем
- •Примеры решения задач и упражнений
- •Задачи и упражнения для самостоятельного решения
- •2.2. Молекулярно-кинетические и оптические свойства коллоидных систем
- •2.2.1. Броуновское движение, диффузия, осмотическое давление. Их взаимосвязь
- •Примеры решения задач и упражнений
- •Задачи и упражнения для самостоятельного решения
- •2.2.2. Седиментация
- •Примеры решения задач и упражнений
- •Задачи и упражнения для самостоятельного решения
- •2.2.3. Рассеяние и поглощение света
- •Примеры решения задач и упражнений
- •Задачи и упражнения для самостоятельного решения
- •2.3. Строение и электрический заряд коллоидных частиц. Электрокинетические явления
- •2.3.1. Строение и электрический заряд коллоидных частиц
- •Примеры решения задач и упражнений
- •Задачи и упражнения для самостоятельного решения
- •2.3.2. Природа электрокинетических явлений
- •Примеры решения задач и упражнений
- •Задачи и упражнения для самостоятельного решения
- •2.4. Устойчивость и коагуляция коллоидных систем
- •2.4.1. Кинетическая и термодинамическая устойчивость коллоидных систем
- •Задачи и упражнения для самостоятельного решения
- •2.4.2. Гелеобразование (желатинирование)
- •Свойства гелей
- •Задачи и упражнения для самостоятельного решения
- •2.4.3. Теории коагуляции
- •1. Адсорбционная теория коагуляции г. Фрейндлиха
- •2. Электростатическая теория коагуляции г. Мюллера
- •3. Теория устойчивости гидрофобных дисперсных систем длфо
- •Примеры решения задач и упражнений
- •Задачи и упражнения для самостоятельного решения
- •2.5. Разные классы коллоидных систем
- •2.5.1. Аэрозоли и их свойства
- •Примеры решения задач и упражнений
- •Задачи и упражнения для самостоятельного решения
- •2.5.2. Порошки и их свойства
- •Примеры решения задач и упражнений
- •Задачи и упражнения для самостоятельного решения
- •2.5.3. Суспензии и их свойства
- •Примеры решения задач и упражнений
- •Задачи и упражнения для самостоятельного решения
- •2.5.4. Эмульсии и их свойства
- •Примеры решения задач и упражнений
- •Задачи и упражнения для самостоятельного решения
- •2.5.5. Пены и их свойства
- •2.5.6. Коллоидные системы, образованные поверхностно-активными веществами
- •Свойства коллоидных растворов пав
- •Примеры решения задач и упражнений
- •Задачи и упражнения для самостоятельного решения
- •2.5.7. Высокомолекулярные соединения (вмс) и их растворы
- •2.5.8. Полимерные полиэлектролиты
- •2.5.9. Набухание и растворение вмс
- •Примеры решения задач и упражнений
- •Задачи и упражнения для самостоятельного решения
- •2.5.10. Вязкость растворов вмс
- •Примеры решения задач и упражнений
- •Задачи и упражнения для самостоятельного решения
- •2.5.11. Осмотические свойства растворов вмс
- •Примеры решения задач и упражнений
- •Задачи и упражнения для самостоятельного решения
- •2.5.12. Факторы устойчивости растворов вмс
- •Предметный указатель
- •Приложение
- •1. Основные единицы измерения физических величин
- •2. Основные физические постоянные
- •Литература Основная
- •Дополнительная
2.5.9. Набухание и растворение вмс
В отличие от процесса растворения низкомолекулярного вещества, при котором происходит в основном диффузия растворяемого вещества в растворитель, начальная стадия процесса растворения ВМС заключается в диффузии молекул растворителя в объем полимера. Проникновение молекул растворителя в объем полимера сопровождается процессом набухания.
Набухание – самопроизвольный процесс поглощения полимером растворителя, сопровождаемый увеличением объема и массы взятого образца ВМС
Процесс растворения можно условно разделить на четыре стадии. В первой стадии (рис. 47, а) до начала растворения система состоит из чистых компонентов: низкомолекулярной жидкости и полимера. Это объясняется тем, что макромолекулы полимеров гибкие, и маленькие молекулы растворителя проникают в полимер, раздвигают звенья цепей полимера, разрыхляя его. Расстояния между молекулами в образце полимера, таким образом, становятся больше, что сопровождается увеличением его массы и объема. Вторая стадия растворения (рис. 47, б) заключается в том, что по мере набухания объем полимера и расстояние между макромолекулами увеличивается настолько, что макромолекулы начинают отрываться друг от друга и переходить в слой низкомолекулярной жидкости. В третьей стадии растворения (рис. 47, в) молекулы полимера равномерно распределяются по своему объему системы, образуя истинный гомогенный раствор.
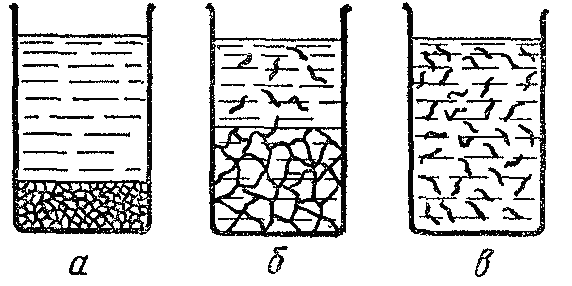
Рис. 47. Последовательные стадии взаимного растворения высокомолекулярного соединения в низкомолекулярной жидкости
Количественной мерой набухания является степень набухания α, которая может иметь объемное и массовое выражение:
|
(0) |
или
|
(0) |
где V и V0, m и m0 – соответственно объемы и массы исходного и набухшего образца полимера.
Степень набухания, прежде всего, зависит от природы полимера, то есть от жесткости его цепей, обусловленной межмолекулярными взаимодействиями между ними, и лиофильности его макромолекул (сродства к растворителю). В зависимости от этих факторов и температуры набухание может быть ограниченным или неограниченным (рис. 48).

Рис. 48. Кинетика набухания различных ВМС
При ограниченном набухании α достигает предельного значения, после чего не зависит от времени. Так набухают амилаза (составляющая крахмала) и желатин в теплой воде. В этих условиях межмолекулярные взаимодействия в полимере достаточно сильны, и растворитель не в состоянии разобщить макромолекулы, поэтому набухание прекращается. В горячей воде амилаза и желатин набухают неограниченно , при этом значение α вначале возрастает, а затем падает до нуля в результате постепенного растворения желатина или амилазы.
При ограниченном набухании полимеров степень набухания изменяется во времени в соответствии с уравнением:
|
(0) |
интегрируя это уравнение, получаем:
|
(0) |
На процесс набухания полимеров в воде влияет присутствие электролитов и значение рН среды. Влияние электролитов своеобразно прежде всего тем, что влияние оказывают в основном анионы, а катионы – лишь в незначительной степени. Причем одни анионы усиливают набухание, а другие ослабляют:
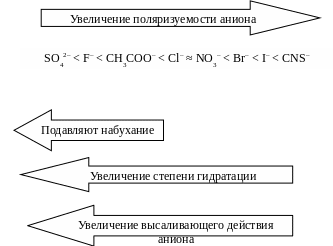

Влияние рН среды на набухание полимера больше всего проявляется в растворах белков (рис. 49), поскольку их молекулы – полиамфолиты. Так, минимум набухания белков лежит в области их изоэлектрической точки рН = pI. По разные стороны этой точки степень набухания возрастает и, достигнув максимумов, вновь уменьшается. Такое влияние рН на набухание связано с тем, что в изоэлектрической точке конформация макромолекул белка наиболее плотная и поэтому степень его гидратации, а, следовательно, и склонность к набуханию и растворению минимальны. Появление максимумов в кислой и щелочной среде связано с переходом белка в этих средах в катион или анион:
![]()
Таким образом, по зависимости степени набухания от рН можно определить изоэлектрическую точку белка.
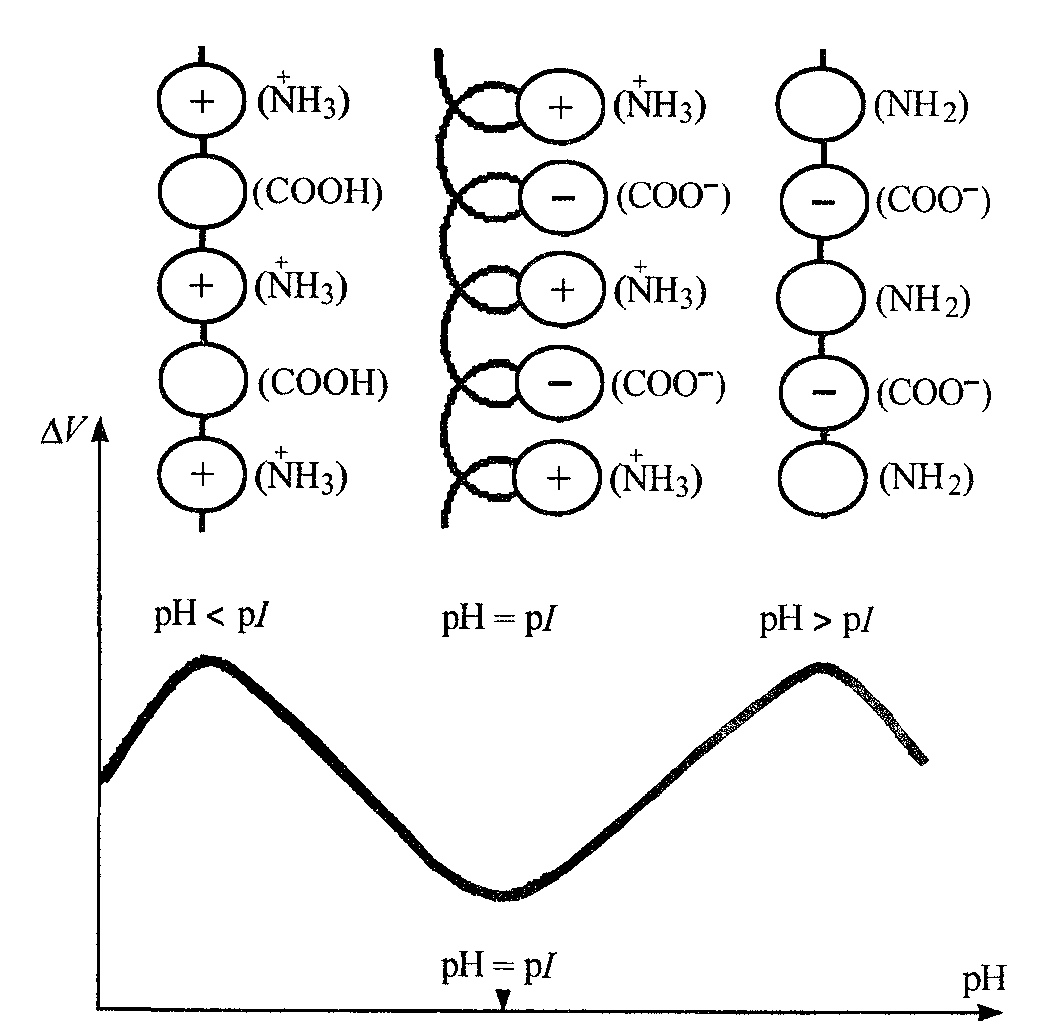
Рис. 49. Влияние рН раствора на набухание белков
