
- •Глава 1. Общие вопросы отбора, консервирования и подготовки проб воды к анализу
- •Питьевая вода и вода для промышленных целей Требования, предъявляемые к воде
- •Питьевая вода
- •Вода для промышленных целей
- •Отбор проб воды и пробоподготовка их к анализу
- •Виды отбора проб
- •Виды проб
- •Оборудование для отбора проб воды
- •Отбор проб воды из различных источников
- •Консервирование проб
- •2.10. Определение цветности воды
- •1. Визуальное определение цветности
- •2. Фотоэлектроколориметрическое определение цветности
- •1. Приготовление растворов.
- •2. Приготовление имитационной шкалы цветности.
- •3. Выбор условий определения.
- •4. Построение градуировочного графика.
- •5. Определение цветности анализируемой воды.
- •2.12. Определение кислорода, растворенного в воде. Бпк
- •1. Калибрование кислородной склянки.
- •2. Определение растворенного кислорода.
- •3. Определение бпк
- •3.1. Определение нитритов в воде.
- •1. Приготовление основного раствора
- •2. Приготовление рабочего раствора № 1
- •3. Приготовление рабочего раствора № 2.
- •4. Приготовление серии стандартных растворов.
- •5. Подготовка пробы анализируемой воды.
- •6. Выбор условий определения
- •7. Построение градуированного графика
- •8. Определение концентрации нитритов в пробе
- •.6. Определение хлоридов в воде
- •1. Определение хлорид ионов в воде методом осаждения
- •2. Определение хлоридов в воде потенциометрическим методом анализа
- •1) Приготовление основного раствора.
- •2) Приготовление серии стандартных растворов.
- •3) Приготовление фонового раствора.
- •4) Измерение эдс стандартных растворов на приборе рН-340
- •5) Построение градуированного графика в координатах
- •6) Определение концентрации хлоридов в пробе воды.
- •7) Таблица результатов
- •3.7. Определение железа в воде
- •1. Приготовление основного раствора
- •2. Приготовление рабочего раствора
- •3. Приготовление серии стандартных растворов
- •4. Подготовка пробы анализируемой воды
- •5. Выбор условий определения
- •6. Построение градуировочного графика
- •7. Определение концентрации железа в пробе
- •3.8. Определение хрома в воде
- •1. Приготовление основного раствора
- •2. Приготовление рабочего раствора № 1
- •3. Приготовление рабочего раствора № 2
- •4. Приготовление серии стандартных растворов
- •5. Подготовка пробы анализируемой воды
- •6. Выбор условий определения
- •7. Построение градуировочного графика
- •8. Определение концентрации хрома в воде
- •3.10. Определение алюминия в воде
- •1. Приготовление основного раствора
- •2. Приготовление рабочего раствора
- •3. Приготовление серии стандартных растворов.
- •4. Подготовка пробы анализируемой воды.
- •5. Выбор условий определения
- •7. Построение градуированного графика
- •8. Определение концентрации алюминия в пробе
- •3.14. Определение кальция в воде
- •4.1. Определение фенолов в воде
- •Определение летучих с паром фенолов (определение относительно больших концентраций)
- •1. Приготовление основного раствора
- •2. Приготовление рабочего раствора
- •3. Приготовление серии стандартных растворов
- •4. Подготовка пробы анализируемой воды
- •5. Выбор условий определения
- •6. Построение градуированного графика.
- •7. Определение концентрации фенола в воде
6. Выбор условий определения
Условия определения выбирают через 30 минут.
а) Выбор светофильтра. Для практического выбора светофильтра берут стандартный раствор максимальной концентрации. Измеряют абсорбционность (А) этого раствора на всех светофильтрах по отношению к холостому раствору. По полученным данным строят график в координатах: абсорбционность (А) – длина волны падающего света (λ).

Для анализа выбирают тот светофильтр, который дает максимальное значение абсорбционности (А). В данном случае - зеленый светофильтр.
б) Выбор кюветы. Для выбора кюветы (толщины поглощающего слоя) берут стандартный раствор максимальной концентрации. Измеряют абсорбционность (А) на выбранном светофильтре во всех кюветах по отношению к холостому раствору. Абсорционность должна быть близкой к единице.
7. Построение градуированного графика
И змеряют
абсорбционность (А) на выбранном
светофильтре и в выбранной кювете всех
стандартных растворов по отношению к
холостому раствору. Строят график в
координатах абсорбционность (А) –
концентрация (С).
змеряют
абсорбционность (А) на выбранном
светофильтре и в выбранной кювете всех
стандартных растворов по отношению к
холостому раствору. Строят график в
координатах абсорбционность (А) –
концентрация (С).
8. Определение концентрации нитритов в пробе
Измеряют абсорбционность (А) анализируемой воды по отношению к холостому раствору и по градуировочному графику находят концентрацию нитрит – ионов в мг/л.

Примечание. Все измерения абсорбционности проводят по три раза.
Вычисляют средние результаты.
.6. Определение хлоридов в воде
Хлориды являются обычно составной частью большинства естественных вод. Присутствие большого содержания хлоридов геологического происхождения в поверхностных водах – явление редкое. По этой причине обнаружение большого количества хлоридов служит показателем загрязнения воды бытовыми сточными и некоторыми промышленными водами. В промышленных сточных водах содержание хлоридов зависит от характера производства. Постепенное повышение содержания хлоридов в поверхностных водах может служить мерой загрязнения водоемов сточными водами.
ПДК хлоридов для питьевой воды и хозяйственно-бытовых водоемов 350 мг/л, рыбохозяйственных водоемов – 300 мг/л.
Отбор и хранение проб
Пробу отбирают в стеклянную или полиэтиленовую светонепроницаемую посуду, предварительно ополоснув ее анализируемой водой.
Анализ проводится в день отбора пробы или не позднее чем через двое суток при условии хранения пробы при температуре 3 - 4ºС. Пробы не консервируют. Для одного анализа отбирают по три параллельных пробы.
1. Определение хлорид ионов в воде методом осаждения
Сущность метода определения
Метод основан на титровании ионов хлора в нейтральной или слабощелочной среде стандартным раствором нитрата серебра в присутствии индикатора хромата калия.
NaCl + AgNO3 = AgCl↓ + NaNO3
2AgNO3 + K2CrO4 = Ag2CrO4↓ + 2KNO3
Mэ(Cl) = M = 35,46 г/моль (мг/ммоль)
После осаждения AgCl в точке эквивалентности от добавления одной избыточной капли AgNO3 образуется осадок Ag2CrO4, при этом желтая окраска переходит в красно – кирпичную.
Хлорид-ионы определяют с массовой концентрацией до 100 мг/л.
Методика определения
Для анализа обирают примерно 350 мл анализируемой воды. рН титруемой пробы должен быть в пределах 6 – 10. Если вода мутная ее отфильтровывают через беззольный фильтр. Если вода имеет цветность выше 30о, пробу обесцвечивают добавлением Al(OH)3. Для этого к 350 мл анализируемой воды добавляют 10 мл суспензии Al(OH)3 и смесь встряхивают до обесцвечивания воды. Затем пробу воды отфильтровывают через беззольный фильтр. Первые порции фильтрата отбрасывают.
100,00 мл анализируемой воды отмеривают мерной колбой, переносят в коническую колбу. Добавляют 1 мл индикатора 10% раствора K2CrO4. Полученную смесь титруют стандартным раствором нитрата серебра 0,1н до перехода окраски из желтой в кирпично-красную. Записывают объем AgNO3, израсходованный на титрование. Титрование повторяют три раза. Вычисляют средний объем AgNO3, израсходованный на титрование.
Параллельно проводят холостой опыт с дистиллированной водой.
Хлорид ионы вычисляют в мг/л по формуле:
 ,
,
где Сн(AgNO3) – нормальная концентрация нитрата серебра, моль/л;
К – поправочный коэффициент к 0,1н раствору AgNO3
V2 – средний объем AgNO3, израсходованный на титрование анализируемой пробы воды в мл;
V1 – средний объем AgNO3, израсходованный на титрование холостой пробы воды, мл;
Мэ(Cl) – молярная масса эквивалента иона Cl, г/моль;
V(H2O) – объем анализируемой воды, мл;
1000 – перевод миллилитров в литры.
ПРИМЕР РАСЧЕТА
Для анализа на содержание ионов хлора взяли 100,00 мл анализируемой воды и оттитровали 0,70 мл стандартным раствором AgNO3. Сн(AgNO3) = 0,1012 моль/л.
Вычислить массовую концентрацию ионов Cl в анализируемой воде в мг/л, если на титрование холостой пробы пошло 0,30 мл того же стандартного раствора AgNO3.
Дано:
V(H2O) = 100,00 мл
V1(AgNO3) = 0,30 мл
V2(AgNO3) = 0,70 мл
Сн(AgNO3) = 0,1012 моль/л
Мэ(Cl) = 35,46 г/моль
Cm(Cl) - ? мг/л
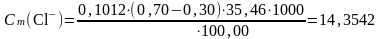 мг/л
мг/л
(1) (2) (3) (4) (5)
1) Сколько миллимоль-эквивалентов AgNO3 содержится в 1 мл раствора;
2) Сколько миллимоль-эквивалентов AgNO3 содержится в 0,40 мл раствора, столько же миллимоль-эквивалентов Cl содержится в 100 мл воды;
3) Сколько мг ионов Cl содержится в 100 мл воды;
4) Сколько мг ионов Cl содержится в 1 мл воды;
5) Сколько мг ионов Cl содержится в 1000 мл воды.
