- •Глава 1. Общие вопросы отбора, консервирования и подготовки проб воды к анализу
- •Питьевая вода и вода для промышленных целей Требования, предъявляемые к воде
- •Питьевая вода
- •Вода для промышленных целей
- •Отбор проб воды и пробоподготовка их к анализу
- •Виды отбора проб
- •Виды проб
- •Оборудование для отбора проб воды
- •Отбор проб воды из различных источников
- •Консервирование проб
- •2.10. Определение цветности воды
- •1. Визуальное определение цветности
- •2. Фотоэлектроколориметрическое определение цветности
- •1. Приготовление растворов.
- •2. Приготовление имитационной шкалы цветности.
- •3. Выбор условий определения.
- •4. Построение градуировочного графика.
- •5. Определение цветности анализируемой воды.
- •2.12. Определение кислорода, растворенного в воде. Бпк
- •1. Калибрование кислородной склянки.
- •2. Определение растворенного кислорода.
- •3. Определение бпк
- •3.1. Определение нитритов в воде.
- •1. Приготовление основного раствора
- •2. Приготовление рабочего раствора № 1
- •3. Приготовление рабочего раствора № 2.
- •4. Приготовление серии стандартных растворов.
- •5. Подготовка пробы анализируемой воды.
- •6. Выбор условий определения
- •7. Построение градуированного графика
- •8. Определение концентрации нитритов в пробе
- •.6. Определение хлоридов в воде
- •1. Определение хлорид ионов в воде методом осаждения
- •2. Определение хлоридов в воде потенциометрическим методом анализа
- •1) Приготовление основного раствора.
- •2) Приготовление серии стандартных растворов.
- •3) Приготовление фонового раствора.
- •4) Измерение эдс стандартных растворов на приборе рН-340
- •5) Построение градуированного графика в координатах
- •6) Определение концентрации хлоридов в пробе воды.
- •7) Таблица результатов
- •3.7. Определение железа в воде
- •1. Приготовление основного раствора
- •2. Приготовление рабочего раствора
- •3. Приготовление серии стандартных растворов
- •4. Подготовка пробы анализируемой воды
- •5. Выбор условий определения
- •6. Построение градуировочного графика
- •7. Определение концентрации железа в пробе
- •3.8. Определение хрома в воде
- •1. Приготовление основного раствора
- •2. Приготовление рабочего раствора № 1
- •3. Приготовление рабочего раствора № 2
- •4. Приготовление серии стандартных растворов
- •5. Подготовка пробы анализируемой воды
- •6. Выбор условий определения
- •7. Построение градуировочного графика
- •8. Определение концентрации хрома в воде
- •3.10. Определение алюминия в воде
- •1. Приготовление основного раствора
- •2. Приготовление рабочего раствора
- •3. Приготовление серии стандартных растворов.
- •4. Подготовка пробы анализируемой воды.
- •5. Выбор условий определения
- •7. Построение градуированного графика
- •8. Определение концентрации алюминия в пробе
- •3.14. Определение кальция в воде
- •4.1. Определение фенолов в воде
- •Определение летучих с паром фенолов (определение относительно больших концентраций)
- •1. Приготовление основного раствора
- •2. Приготовление рабочего раствора
- •3. Приготовление серии стандартных растворов
- •4. Подготовка пробы анализируемой воды
- •5. Выбор условий определения
- •6. Построение градуированного графика.
- •7. Определение концентрации фенола в воде
7. Построение градуированного графика
Измеряют абсорбционность (А) на выбранном светофильтре и в выбранной кювете всех стандартных растворов по отношению к холостому раствору. Строят график в координатах абсорбционность (А) – концентрация (С).

8. Определение концентрации алюминия в пробе
Измеряют абсорбционность (А) анализируемой воды по отношению к холостому раствору и по градуировочному графику находят концентрацию ионов алюминия в мг/л.

Примечание. Все измерения абсорбционности проводят по три раза.
Вычисляют средний результат.
3.14. Определение кальция в воде
Соли кальция постоянно входят в состав подземных и поверхностных вод. Пробу воды не консервируют, срок хранения двое суток.

MЭ(Ca2+)
=
 = 20,04 г/моль (мг/ммоль)
= 20,04 г/моль (мг/ммоль)
Ионы кальция в щелочной среде образуют с мурексидом комплексное соединение, окрашенное в оранжево-розовый цвет. При титровании раствором трилона Б происходит разрушение менее прочного комплексного соединения индикатора с металлом и образование комплексоната кальция. В точке эквивалентности появляется цвет индикатора мурексида, который при рН > 10 окрашен в лиловый цвет.
CaCl2 + NaH2Ind + 2NaOH = NaCaInd + 2NaCl + 2H2O
оранжево-розовый
NaCaInd + Na2H2Tr = Na2CaTr + NaH2Ind
бесцветный лиловый
Методика определения
100,00
мл анализируемой воды отмеривают мерной
колбой, переносят в коническую колбу,
добавляют 5 мл 2н раствора NaOH
(рН
 12)
, 0,1 г индикатора мурексида. Полученную
смесь титруют стандартным раствором
трилона Б 0,05н до перехода оранжево-розовой
окраски в лиловую. Записывают объем
трилона Б, израсходованный на титрование.
Титрование повторяют три раза. Вычисляют
средний объем трилона Б.
12)
, 0,1 г индикатора мурексида. Полученную
смесь титруют стандартным раствором
трилона Б 0,05н до перехода оранжево-розовой
окраски в лиловую. Записывают объем
трилона Б, израсходованный на титрование.
Титрование повторяют три раза. Вычисляют
средний объем трилона Б.
Содержание ионов кальция в мг/л вычисляют по формуле:
Сm(Ca2+)=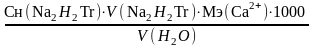 ,
,
где Сн(Na2H2Tr) – нормальная концентрация трилона Б, моль/л;
V(Na2H2Tr) – средний объем трилона Б, израсходованный на титрование анализируемой пробы воды, мл;
Мэ(Са2+) – молярная масса эквивалента иона Са2+, в г/моль;
V(H2O) – объем анализируемой пробы воды, мл ;
1000 – перевод миллилитров в литры.
4.1. Определение фенолов в воде
К фенолам относятся органические соединения с гидроксидной группой в бензольном кольце.
Фенолы присутствуют в бытовых сточных водах и в разнообразных производственных сточных водах химических, нефтеперерабатывающих, нефтехимических, лесохимических, коксохимических, фармацевтических, металлургических, шпалопропиточных, анилинокрасочных и других производств.
В естественных условиях фенолы образуются в процессе метаболизма водных организмов, при биохимическом распаде и трансформации органических веществ.
Фенолы делят на две группы: летучие с паром и нелетучие.
Летучие с паром - это ряд соединений, перегоняющихся с водяным паром.
фенол |
о-крезол |
м-крезол |
п-крезол |
ксиленолы |
||
|
|
|
|
|
|
тимол |
гваякол |
Летучие с паром фенолы являются основным компонентом фенольных сточных вод, и вместе с ними они попадают в канализационную сеть и в поверхностные воды, загрязняя их.
Летучие с паром фенолы более токсичные, обладают более интенсивным запахом, чем нелетучие, поэтому допустимые концентрации их в водоемах чрезвычайно малы.
Особенно жесткие требования предъявляются к воде, поступающей на водопроводные станции, где она подвергается обработке хлорированием, потому что хлорпроизводные фенола, О – крезолы, м – крезол имеют неприятный запах даже в самых малых концентрациях.
Для летучих с паром фенолов предельно допустимая концентрация (ПДК) 0,001 мг/л
Нелетучие фенолы
резорцин ПДК = 0,1 мг/л |
пирокатехин
|
-нафтол ПДК = 0,4 мг/л |
Так как значения ПДК для разных фенолов различно, то их определяют раздельно.
Для отбора проб воды на содержание фенола используют стеклянные бутыли. Определяют фенолы сразу после отбора пробы. Если это невозможно, пробу воды консервируют добавлением 4 г щелочи на 1 литр воды и хранят пробу при температуре 4оС 1 –2 суток.