
- •Глава 1. Общие вопросы отбора, консервирования и подготовки проб воды к анализу
- •Питьевая вода и вода для промышленных целей Требования, предъявляемые к воде
- •Питьевая вода
- •Вода для промышленных целей
- •Отбор проб воды и пробоподготовка их к анализу
- •Виды отбора проб
- •Виды проб
- •Оборудование для отбора проб воды
- •Отбор проб воды из различных источников
- •Консервирование проб
- •2.10. Определение цветности воды
- •1. Визуальное определение цветности
- •2. Фотоэлектроколориметрическое определение цветности
- •1. Приготовление растворов.
- •2. Приготовление имитационной шкалы цветности.
- •3. Выбор условий определения.
- •4. Построение градуировочного графика.
- •5. Определение цветности анализируемой воды.
- •2.12. Определение кислорода, растворенного в воде. Бпк
- •1. Калибрование кислородной склянки.
- •2. Определение растворенного кислорода.
- •3. Определение бпк
- •3.1. Определение нитритов в воде.
- •1. Приготовление основного раствора
- •2. Приготовление рабочего раствора № 1
- •3. Приготовление рабочего раствора № 2.
- •4. Приготовление серии стандартных растворов.
- •5. Подготовка пробы анализируемой воды.
- •6. Выбор условий определения
- •7. Построение градуированного графика
- •8. Определение концентрации нитритов в пробе
- •.6. Определение хлоридов в воде
- •1. Определение хлорид ионов в воде методом осаждения
- •2. Определение хлоридов в воде потенциометрическим методом анализа
- •1) Приготовление основного раствора.
- •2) Приготовление серии стандартных растворов.
- •3) Приготовление фонового раствора.
- •4) Измерение эдс стандартных растворов на приборе рН-340
- •5) Построение градуированного графика в координатах
- •6) Определение концентрации хлоридов в пробе воды.
- •7) Таблица результатов
- •3.7. Определение железа в воде
- •1. Приготовление основного раствора
- •2. Приготовление рабочего раствора
- •3. Приготовление серии стандартных растворов
- •4. Подготовка пробы анализируемой воды
- •5. Выбор условий определения
- •6. Построение градуировочного графика
- •7. Определение концентрации железа в пробе
- •3.8. Определение хрома в воде
- •1. Приготовление основного раствора
- •2. Приготовление рабочего раствора № 1
- •3. Приготовление рабочего раствора № 2
- •4. Приготовление серии стандартных растворов
- •5. Подготовка пробы анализируемой воды
- •6. Выбор условий определения
- •7. Построение градуировочного графика
- •8. Определение концентрации хрома в воде
- •3.10. Определение алюминия в воде
- •1. Приготовление основного раствора
- •2. Приготовление рабочего раствора
- •3. Приготовление серии стандартных растворов.
- •4. Подготовка пробы анализируемой воды.
- •5. Выбор условий определения
- •7. Построение градуированного графика
- •8. Определение концентрации алюминия в пробе
- •3.14. Определение кальция в воде
- •4.1. Определение фенолов в воде
- •Определение летучих с паром фенолов (определение относительно больших концентраций)
- •1. Приготовление основного раствора
- •2. Приготовление рабочего раствора
- •3. Приготовление серии стандартных растворов
- •4. Подготовка пробы анализируемой воды
- •5. Выбор условий определения
- •6. Построение градуированного графика.
- •7. Определение концентрации фенола в воде
1. Приготовление основного раствора
ЗАДАЧА. Сколько граммов железоаммонийных квасцов необходимо взять для приготовления 1 литра раствора с массовой концентрацией железа 0,1 мг/мл?
Дано: Сm(Fe3+) = 0,10 мг/мл (г/л)
М(Fe3+) = 55,85 г/моль
М(NH4Fe(SO4)2.12Н2О) = 482,18 г/моль
Vм.к. = 1000,00 мл
Вычислить массу навески mн
mн
=
 =
0,8634 г
=
0,8634 г
(1) (2)
1) Сколько моль железа содержится в 1 литре раствора; столько же моль железоаммонийных квасцов содержится в 1 литре раствора;
2) Сколько г железоаммонийных квасцов содержится в 1 литре раствора.
Методика приготовления раствора
0,8634 г железоаммонийных квасцов взвешивают на аналитических весах, количественно переносят в мерную колбу 1 литр, добавляют 10 мл концентрированной Н2SО4, растворяют, объём в мерной колбе доводят дистиллированной водой до метки, закрывают пробкой, перемешивают.
2. Приготовление рабочего раствора
ЗАДАЧА. В мерной колбе 500 мл приготовить рабочий раствор с массовой концентрацией железа 0,01 мг/мл из основного раствора с массовой концентрацией железа 0,1 мг/мл.
Дано: Сm(Fe3+)1 = 0,10 мг/мл
Сm(Fe3+)2 = 0,010 мг/мл
Vм.к. = 500,00 мл
Вычислить объём основного раствора?

Методика приготовления рабочего раствора
50,00 мл основного раствора отмеривают пипеткой, переносят в мерную колбу 500 мл, разбавляют дистиллированной водой до метки, закрывают пробкой, перемешивают.
3. Приготовление серии стандартных растворов
В мерные колбы 100,00 мл по бюретке отмеряют рабочий раствор: 0 мл; 1,00 мл; 2,00 мл; 4,00 мл; 10,00 мл; 20,00 мл; 40,00 мл; 60,00 мл. В каждую мерную колбу добавляют дистиллированную воду примерно до 80 мл, затем с помощью пипеток добавляют 2 мл NH4Cl, 2 мл сульфосалициловой кислоты, 2 мл раствора аммиака (рН = 8 – 10). Объём доводят в мерных колбах до метки, закрывают пробкой, перемешивают.
Вычисление концентрации приготовленных стандартных растворов:



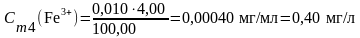




4. Подготовка пробы анализируемой воды
100,00 мл анализируемой воды отмеривают мерной колбой, переносят в коническую колбу или стакан, добавляют 0,5 мл концентрированной азотной кислоты (для окисления Fe2+ в Fe3+) и упаривают до малого объёма. Затем разбавляют дистиллированной водой и количественно переносят в мерную колбу 100,00 мл, дистиллированной водой объём раствора доводят примерно до 80 мл.
Далее с помощью пипеток приливают 2 мл NН4Сl, 2 мл сульфосалициловой кислоты, 2 мл раствора аммиака (рН = 8 – 10). Объём доводят дистиллированной водой до метки, закрывают пробкой, перемешивают.
5. Выбор условий определения
Условия определения выбирают через 10 минут.
а) Выбор светофильтра. Для практического выбора светофильтра берут стандартный раствор максимальной концентрации. Измеряют абсорбционность (А) этого раствора на всех светофильтрах по отношению к холостому раствору. По полученным данным строят график в координатах: абсорбционность (А) - длина волны падающего света ().
Для анализа выбирают тот светофильтр, который дает максимальное значение абсорбционности (А). В данном случае - синий светофильтр.
б) Выбор кюветы. Для выбора кюветы (толщины поглощающего слоя) берут стандартный раствор максимальной концентрации. Измеряют абсорбционность (А) на выбранном светофильтре во всех кюветах по отношению к холостому раствору. Абсорбционность должна быть близкой к единице.
