
спектр и фотометр
.pdf
Поглощение света молекулой осуществляется избирательно: поглощаются те кванты света, энергия которых равна разности энергий (∆E) между орбиталями основного и возбуждённого состояний (см. рис. 2). Чем меньше эта разность, тем больших длин волн поглощается свет. Наибольшая энергия требуется для осуществления σ→ σ* электронного перехода. Поэтому соединения, у которых имеются только σ-связи, например алканы и циклоалканы, не поглощают свет в рабочем интервале серийных УФ-спектрофотометров (200-800 нм). В связи с этим они могут использоваться в качестве растворителей при снятии УФ-спектров других соединений. Аналогичное применение находят насыщенные соединения, содержащие гетероатомы с неподеленными парами электронов (О, N, S, галогены). Хотя в их спектрах возможно проявление n-σ* перехода, максимум поглощения в таких соединениях, как спирты, простые эфиры, хлоралканы все же не превышает 200 нм.
Рис. 2. Типы электронных переходов при поглощения света
Способность поглощать свет представляет собой суммарное свойство всех связей молекулы в целом. Однако некоторые полосы поглощения в УФ-спектре можно отнести к электронным переходам в отдельных структурных фрагментах молекулы, называемых хромофорами (табл. 1). К ним относятся многие функциональные группы, в которых атом с неподелённой парой электронов связан с соседним атомом кратной связью. В таких группах, кроме σ→ σ*, возможны еще два электронных перехода: π → π* и n→ π*. Если π → π* переход в изолированных хромофорах всегда находится в дальней УФ-области (<200 нм), то n→ π* переход уже проявляется, в ближней УФ-области и может быть использован в практических целях. Например, очень важно значение переходов π → π* и n→ π*, поскольку только им соответствуют длины волн, попадающие
11

в рабочий диапазон прибора. Исключение составляют переходы π → π* изолированных двойных связей С = С и C=N, а также тройных связей
С≡С и C≡N (λmax 160-180 нм). Для изолированных кратных связей в используемом для измерений интервале проявляется только переход
карбонильной группы C=O (λmax ~ 270 им).
Основными хромофорами, дающими максимум поглощения в области 200-800 нм, являются системы сопряженных двойных связей (см. табл. 1). С ростом числа сопряженных двойных связей энергия, необходимая для возбуждения электронов, будет уменьшаться, и поглощение света будет наблюдаться при больших длинах волн. В ароматических системах переход электрона в возбужденное состояние осуществляется также при меньшей затрате энергии, чем в случае изолированной двойной связи. Таким образом, основными хромофорами в УФ-спектроскопии являются сопряженные С=С-связи, карбонильная группа С=О, системы С=С – С =О, ароматическое ядро.
|
|
|
|
Таблица 1 |
|
Электронные переходы в изолированных и сопряженных хромофорах |
|||||
|
|
|
Тип переходов |
|
|
Хромофор |
Соединение |
π → π* |
|
π → π* |
|
|
|
λ макс, нм |
ε макс |
λ макс, нм |
ε макс |
С=С |
H2C=CH2 |
165 |
15000 |
|
|
C≡C |
HC≡CH |
173 |
6000 |
|
|
C=O |
CH3-CO-CH3 |
187 |
1000 |
271 |
16 |
=C=N- |
CH3-CH=N-OH |
190 |
8000 |
279 |
15 |
-NO2 |
CH3-NO2 |
210 |
15000 |
271 |
19 |
C=C-C=C |
H2C=CH-CH=CH2 |
217 |
20900 |
|
|
C=C-C= |
H2C=CH- |
256 |
22400 |
|
|
=C-C=C- |
-HC=CH-CH=CH2 |
|
|
||
|
|
|
|
||
C=C-C=O |
H2C=CH-CHO |
230 |
12600 |
327 |
40 |
|
|
207 |
7000 |
|
|
|
|
261 |
225 |
|
|
|
|
12 |
|
|
|

УФ-спектр органического вещества характеристичен, так как поглощение определяется только собственно хромофором и его ближайшим окружением, т. е. один и тот же хромофор проявляется практически одинаково как в исключительно простых, так и самых сложных молекулах. В зависимости от непосредственного окружения одной и той же хромофорной группировки положение максимума поглощения в УФ-спектрах различных соединений может несколько изменяться. Сдвиг максимума в сторону более длинных волн принято называть батохромным сдвигом, а сдвиг сторону более коротких волн – гипсохромным.
Интенсивность поглощения в спектре связана с вероятностью данного типа электронного перехода. Однако далеко не все переходы, формально кажущиеся возможными, осуществляются в действительности. Существуют так называемые правила отбора, определяющие разрешенные и запрещенные переходы. Эти правила учитывают в основном симметрию молекулы, а также электронную симметрию основного и возбужденного состояний; запрещены переходы, при которых происходит изменение спина электрона. Интенсивность поглощения, соответствующего разрешенным переходам, обычно высока, мольный коэффициент погашения достигает тысяч, а иногда и сотен тысяч единиц, тогда как для запрещенных переходов значение ε составляет десятки, реже – сотни единиц. Спектрометры для получения УФ-спектров имеют следующее устройство (см. рис. 3 и 4).
Рис. 3. Схема фотометрического однолучевого прибора с прямым способом измерения:
1 – источник света; 2 – линза; 3 – светофильтр или монохроматор; 4 – кювета с раствором сравнения; 5 – кювета с фотометрируемым раствором;
6 – фотоэлемент; 7 – усилитель; 8 – регистрирующий прибор
На рисунках 5-7 представлены некоторые спектрофотометры, отвечающие требованиям современной науки и практики.
13

Рис. 4. Схема фотометрического двулучевого прибора с компенсационным способом измерения:
1 – источник света; 2 – светофильтр; 3 – призма; 4, 4’ – зеркала; 5, 5’ – кюветы с раствором сравнения и фотометрируемым раствором
соответственно; 6, 6’ – щелевые диафрагмы; 7, 7’ – фотоэлементы; 8 – усилитель; 9 – нуль-индикатор
Рис. 5. УФ/Вид. |
Рис. 6. УФ/Вид. |
спектрофотометры Evolution |
спектрофотометры Helios |
• Исследовательского класса, |
• Опыт производства (Unicam) |
точные и простые в использовании |
спектрофотометров более 50 лет |
спектрофотометры |
• Надежные и недорогие |
с широким набором приставок |
для использования в учебных |
• Идентификация и количественный |
и заводских лабораториях |
анализ химических |
|
и биологических веществ |
|
14

Рис. 7. UV-Vis спектрофотометр
•Совершенная конструкция, отвечающая требованиям фармакопеи США и европейских стран.
•Минимальное количество движущихся частей (только вентилятор и шторка для проверки настройки длин волн и темного тока)
•Широкодиапазонная диодная матрица
диапазон длин волн: 190-1100 нм; разрешающая способность: 1 нм; скорость сканирования 0,1 сек;
•Удобство и надежность эксплуатации.
•Обеспечение быстрых измерений, обработки данных и распечатки результатов.
•Программное обеспечение для автоматической метрологической аттестации всей системы.
•Универсальное программное обеспечение для качественного и количественного анализа.
•Возможность обработки спектров с использованием 17 математических функций.
•Расширение возможностей для биохимического анализа.
•Стандартная проверка чистоты нуклеиновых кислот; количественное определение содержания нуклеиновых кислот и белков в смесях.
•Различные варианты кинетических исследований.
•Возможность проведения исследований денатурации под тепловым воздействием (определение точки плавления ДНК или конформационных изменений белков).
15

• Контроль растворимости высвобождения лекарственного вещества из лекарственной формы.
Всовременных регистрирующих приборах (см. рис. 5-7) световой поток делится на два одинаковых пучка, один из которых проходит через исследуемый раствор, а другой – через растворитель, причем как сравнение интенсивностей прошедших через кюветы световых потоков, так
инепрерывное изменение длин волн производится автоматически. В том
идругом случае получают УФ-спектр вещества, представляющий собой зависимость оптической плотности раствора (А) от длины волны поглощаемого света:
А= lg (I0/I)
Вточках максимума мольный коэффициент погашения вычисляют по формуле: ε = А/(C·l).
Пример 1. После трех последовательных разведений получен раствор, содержащий 3,061·10-4 г циклопентадиена в 9,3721 г гексана (плотность гексана 0,6603); оптическая плотность раствора в кювете с длиной
оптического пути 1 см при λmax 240 нм составляет 1,1. Вычислите мольный коэффициент поглощения.
Решение. Определим концентрацию раствора (С) в моль/л, пренебрегая разностью в плотности вещества и растворителя и учитывая, что молекулярная масса циклопентадиена С5Н6 равна 66,10:
Окончательная обработка спектра приводит к зависимости мольного коэффициента погашения от длины волны (или частоты). В настоящее время все чаще пользуются шкалой частот (точнее, волновых чисел), выраженных в см-1, так как в этом случае энергия линейно изменяется по оси абсцисс. В связи с тем, что значения ε могут колебаться в очень широких пределах (от десятков до сотен тысяч), кривую УФ-спектра часто представляют в виде зависимости lgε от λ (или от ν). Спектр в большинстве случаев представляет собой кривую с одним пологим максимумом
(см. рис. 8).
16
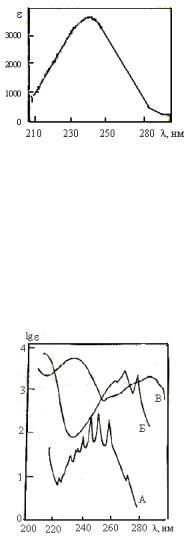
Рис. 8. УФ-спектр циклопентадиена
Большая ширина полосы поглощения обусловлена тем, что помимо основных уровней электронных переходов существуют подуровни, связанные с колебаниями молекулы. Многочисленность таких подуровней обычно приводит к тому, что соответствующие им отдельные максимумы сливаются в один, имеющий пологую форму. В отдельных случаях, например для ароматических соединений, за счет колебательных подуровней максимум поглощения представляет собой набор узких полос по обе стороны от основной (см. рис. 9). В таких случаях принято говорить, что максимум имеет тонкую структуру.
Рис. 9. УФ-спектр бензола (А), фенола (Б), анилина (В)
Обычно УФ-спектр характеризуют длиной волны, при которой наблюдается максимум поглощения, и мольным коэффициентом гашения в этом максимуме. Например, спектр циклопентадиена (см. рис. 8) достаточно точно может быть передан записью: λmax (в гексане) 240 нм (ε 3400). УФ-спектр вещества может иметь несколько максимумов погло-
17

щения, каждый из которых соответствует различным типам электронных переходов. В этом случае при цифровой записи спектра перечисляются длины волн максимумов поглощения и в скобках приводятся значения ε, соответствующие данному максимуму. Если спектр имеет относительно сложный контур (например, тонкая структура какого-либо из максимумов), целесообразно приводить непосредственно рисунок спектра, так как часто его специфические особенности характеристичны и позволяют делать определенные выводы.
Мольный коэффициент погашения для каждого поглощающего в УФ-области вещества при данной длине волны в одном растворителе имеет строго постоянное значение, определяющее оптическую плотность раствора при заданной концентрации. Точность измерения оптической плотности весьма высока – погрешность измерении составляет, в зависимости от конструкции прибора, 0,2-1 % от определяемой величины. Следовательно, измеряя оптическую плотность раствора при известном ε, можно с высокой точностью определять концентрацию вещества. Измерения не обязательно проводить при длине волны, соответствующей максимуму поглощения. Таким образом, УФ-спектроскопия позволяет легко и с высокой степенью точности осуществлять количественный анализ растворов и, в том числе, наблюдать изменение концентрации вещества во времени. Последнее находит широкое применение при исследовании кинетики химических реакций.
Пример 2. В УФ-спектре раствора циклопентадиена в гептане оптическая плотность при λmax 240 нм составляет 0,83 при длине светового пути 1см. Определите концентрацию раствора, если мольный коэффициент погашения равен 3400 л/(моль. см).
Решение. Концентрация раствора определяется как
В качестве растворителей в УФ-спектроскопии используются алканы (гексан, гептан), этанол, вода, реже – диоксан. Концентрации исследуемых растворов (обычно 10-4-10-6 моль/л) подбираются так, чтобы их оптическая плотность находилась в предeлax 0,3-0,7, что обеспечивает максимальную точность измерений. Для получения столь малых концентраций с высокой точностью используется метод последовательных разведений со взвешиванием растворов и растворителя, что дает значительно меньшую ошибку, чем разведение по объему. Необходима особо тщательная очистка применяемых растворителей, так как примесь, например, ароматических соединений в количестве 10-5 моль/л делает ал-
18

каны непригодными для работы. Методы очистки растворителей хорошо отработаны. Наиболее просто (перегонкой) очищается вода – самый доступный растворитель. Замена растворителя в отдельных случаях может вызвать некоторые изменения как в положении полос (на 2-10 нм), так и в их интенсивности (на 10-20 %). Как правило, такая замена влияет на спектры полярных веществ и практически не сказывается на УФ-спек- трах неполярных соединений. Наиболее сильные изменения в спектрах, обусловлены химическим взаимодействием вещества с растворителем (в частности, образованием водородной связи), а также изменением степени диссоциации или соотношения таутомерных форм вещества. Во всех таких случаях следует проверить, выполняется ли для данного раствора закон Бугера – Ламберта – Бера.
Таким образом, УФ-спектроскопия позволяет определить в исследуемых соединениях группировки–хромофоры и дает прекрасную возможность для количественного анализа веществ, содержащих такие группировки. Этот метод находит широкое применение не только в лабораторной практике, но и в химической и пищевой промышленности, например для определения стирола в его смесях с дивинил и бензолом, определения каротиноидов, бензопирена и т. д.
Как структурно-аналитический метод УФ-спектроскопия значительно менее информативна по сравнению с другими методами и носит в основном эмпирический характер, поскольку зависимость между характером поглощения и структурой молекулы не имеет строгого физико-математи- ческого обоснования, что, однако, не мешает широкому использованию метода.
1.3. ОСНОВНЫЕ ТИПЫ ХРОМОФОРОВ
Отсутствие в УФ-спектре исследуемого вещества максимума поглощения в области 200-800 нм служит надежным доказательством того, что в этом веществе не содержатся сопряженные диеновые или полиеновые системы, ароматическое ядро и карбонильная группа. Этот признак часто оказывается полезным при установлении структуры соединения, например, позволяет легко различить изомеры с сопряженными и изолированными двойными связями, как в случае приводимой ниже пары:
19

1.3.1. Диеновые системы.
Для УФ-спекров сопряженных диенов характерен максимум разрешённого перехода π → π* в области 215-270 нм, причем его положение и интенсивность поглощения определяются строением диена и практически не зависят от природы растворителя. Максимум обычно имеет форму пологой кривой. Наибольшее влияние на УФ-спектр диена оказывает конформация диеновой системы. Параметры УФ-спектров основных типов диеновых хромофоров представлены в таблице 2.
Таблица 2
УФ-спектры основных диеновых систем (хромофоров) в гексане или гептане
Хромофор |
Конформация* |
λ макс, нм |
ε |
транс-Бутадиен-1,3 (1) |
Т |
217 |
21000 |
3-Метиленциклопентен-1 (2) |
ЗТ |
234 |
14000 |
|
|
|
|
Циклопентадиен-1,3 (3) |
ЗЦЦ |
240 |
3400 |
|
|
|
|
1,2-Диметиленциклопентан (4) |
ЗЦЭ |
243 |
12000 |
|
|
|
|
3-Метиленциклогексен-1 (5) |
ЗТ |
231 |
19800 |
Циклогексадиен-1,3 (6) |
ЗЦЦ |
258 |
7200 |
1,2-Диметиленциклогексан (7) |
ЗЦЭ |
243 |
12000 |
Циклогептадиен-1,3 (8) |
ЗЦЦ |
248 |
7600 |
*Т – трансоидная; ЗТ – закреплённая трансоидная; ЗЦЦ – закреплённая цисоидная внутри-циклическая; ЗЦЭ – закреплённая цисоидная экзоциклическая.
Ациклические диены существуют практически полностью в трансоидной конформации, так как в ней сопряжение проявляется в большей степени, делает её энергетически более выгодной. В циклических соединениях конформация диеновой системы может быть закреплена. При переходе от диена с двумя внутрициклическими двойными связями к изомерному диену с закрепленной трансоидной системой двойных связей наблюдается гипсохромный сдвиг максимума поглощения на 15-20 нм и увеличение мольного коэффициента погашения не менее чем на 10000-12000. В простейших случаях для изомерного диена с другой кон-
20
