
- •Лекция № 1 классификация органических соединений
- •Лекция № 2
- •Лекция № 3 Изомерия
- •2. Пространственная изомерия (стереохимия)
- •2.1. Конформации (поворотная изомерия)
- •Диаграмма потенциальной энергии конформаций этана.
- •Диаграмма потенциальной энергии конформаций н-бутана.
- •2.2. Геометрическая изомерия
- •2.3. Оптическая изомерия (энантиомерия)
- •Проекционные формулы
- •2.4. Диастереомерия
- •2.5. Методы получения стереоизомеров
- •Лекция № 4 органические кислоты и основания
- •Протонная теория кислот и оснований Брёнстеда
- •Классификация органических кислот и оснований
- •Влияние структурных факторов на относительную силу кислот и оснований
- •Влияние строения на силу кислот и оснований.
- •Кислоты и основания Льюиса
- •Классификация органических реакций и реагентов
- •Углеводороды
- •2. Сульфохлорирование
- •3. Нитрование
- •4. Окисление
- •1.1. Методы получения
- •1.2. Химические свойства
- •1. Реакции электрофильного присоединения
- •Методы получения сопряженных диенов
- •Химические свойства сопряженных диенов
- •Методы получения
- •Химические свойства
- •Методы получения
- •Химические свойства
- •1. Реакции электрофильного замещения.
- •2.2. Реакции с участием боковых цепей алкилбензолов.
- •2.3. Реакции с разрушением ароматической системы.
- •Галогенпроизводные
- •1. Методы получения
- •2. Химические свойства
- •2.1. Реакции нуклеофильного замещения
- •2.2. Реакции элиминирования
- •Альдегиды и кетоны
- •1. Методы получения.
- •2. Химические свойства.
- •2.1. Реакции нуклеофильного присоединения.
- •2.2. Реакции по α -углеродному атому.
- •2.3. Реакции окисления и восстановления
- •Гидроксилпроизводные углеводородов
- •1. Методы получения спиртов.
- •2. Химические свойства спиртов.
- •3. Многоатомные спирты.
- •4. Фенолы. Методы получения.
- •5. Фенолы. Химические свойства.
- •6. Простые эфиры
- •Химические свойства
- •Карбоновые кислоты
- •1. Методы получения
- •2. Химические свойства
- •2.1. Кислотные свойства
- •2.2. Реакции нуклеофильного замещения. Функциональные производные карбоновых кислот.
- •2.3. Реакции по α -углеродному атому
- •2.4. Декарбоксилирование
- •2.5. Восстановление.
- •3. Дикарбоновые кислоты
- •Гидрокси- и оксокислоты
- •1. Гидроксикислоты
- •Методы получения
- •1.2. Химические свойства.
- •1.3. Биологически важные гидроксикислоты.
- •2. Оксокислоты
- •1. Классификация
- •2. Методы получения.
- •3. Химические свойства.
- •Гетероциклические соединения
- •1. Классификация
- •Пятичленные азотсодержащие гетероциклы с одним гетероатомом Пиррол
- •Шестичленные азотсодержащие гетероциклы с одним гетероатомом. Пиридин
- •Пяти- и шестичленные гетероциклы с двумя атомами азота. Имидазол. Пиразол.
- •Пиримидин
- •Лекция № 16 аминокислоты. Пептиды
- •1. Методы получения
- •2. Химические свойства
- •2.1. Кислотно-основные свойства
- •2.2. Реакции по аминогруппе
- •2.3. Реакции по карбоксильной группе
- •2.4. Специфические реакции аминокислот
- •Пептиды
Лекция № 4 органические кислоты и основания
План
Протонная теория кислот и оснований Бренстеда.
Классификация кислот и оснований по Бренстеду.
Влияние структурных факторов на кислотность и основность.
Кислоты и основания Льюиса. Теория жестких и мягких кислот и оснований.
В настоящее время существуют две основных теории кислот и оснований: теория Брёнстеда и теория Льюиса.
Протонная теория кислот и оснований Брёнстеда
Кислоты Брёнстеда – это соединения, способные отдавать протон (доноры протона).
Основания Брёнстеда – это соединения, способные присоединять протон (акцепторы протона). Для взаимодействия с протоном основание должно иметь свободную пару электронов или электроны π-связи.
Кислоты и основания образуют сопряженные кислотно-основные пары, например:
|
CH3COOH |
+ |
H2O |
|
CH3COO- |
+ |
H3O+ |
|
кислота1 |
|
основание2 |
|
основание1 |
|
кислота2 |
|
CH3NH2 |
+ |
H2O |
|
CH3NH3+ |
+ |
OH- |
|
основание1 |
|
кислота2 |
|
кислота1 |
|
основание2 |
В общем виде:
|
Н-А |
+ |
:В |
|
:А |
+ |
Н-В |
|
кислота1 |
|
основание2 |
|
основание1 |
|
кислота2 |
Сила кислоты НА будет зависеть от силы основания :В. Поэтому для создания единой шкалы силу кислот и оснований Бренстеда определяют относительно воды, которая является амфотерным соединением и может проявлять и кислотные, и основные свойства.
Сила кислот определяется константой равновесия их взаимодействия с водой как основанием, например:
CH3COOH + H2O CH3COO- + H3O+
![]()
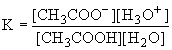
Так как в разбавленных растворах [H2O]=const, то ее можно внести в константу равновесия, которую называют константой кислотности:

На практике чаще пользуются величинами pKa= - lg Ka. Чем меньше величина pKa, тем сильнее кислота.
Сила оснований определяется константой равновесия взаимодействия их с водой как кислотой:
RNH2 + H2O RNH3+ + OH-
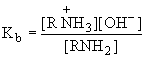 - константа
основности.
- константа
основности.
Для
сопряженных кислоты и основания Ka
Kb=KW.
Таким образом, в сопряженной
кислотно-основной паре, чем сильнее
кислота, тем слабее основание и наоборот.
Силу основания чаще выражают не константой
основности, а константой кислотности
сопряженной кислоты ![]() .
Например, для основания RNH2
величина
.
Например, для основания RNH2
величина ![]() -
это константа кислотности сопряженной
кислоты
-
это константа кислотности сопряженной
кислоты![]() :
:
RNH3+ + H2O RNH2 + H3О+

На
практике чаще пользуются величиной ![]() .
Чем больше величина
.
Чем больше величина![]() ,
тем сильнее основание.
,
тем сильнее основание.
Классификация органических кислот и оснований
Кислоты и основания Брёнстеда классифицируют по природе атома при кислотном или основном центре.
В зависимости от природы элемента, с которым связан протон, различают четыре основных типа органических кислот Брёнстеда:
O-H – кислоты - карбоновые кислоты, спирты, фенолы;
S-H – кислоты - тиолы;
N-H – кислоты - амины, амиды, имиды;
C-H – кислоты - углеводороды и их производные.
В зависимости от природы атома, к неподеленной паре электронов которого присоединяется протон, основания Брёнстеда делят на три основных типа:
N (аммониевые) основания - амины, нитрилы, азотсодержащие гетероциклические соединения;
О (оксониевые) основания - спирты, простые эфиры, альдегиды, кетоны, карбоновые кислоты и их функциональные производные;
S (сульфониевые) основания - тиолы, сульфиды.
Особый тип оснований Бренстеда представляют π-основания, в которых центром основности являются электроны π-связи (алкены, арены).
