
- •Московская Медицинская Академия им. И.М.Сеченова
- •Аттестационный лист студента
- •Основы количественного анализа. Способы выражения концентрации раствора.
- •Задания для самостоятельной работы
- •Основы количественного анализа.
- •Кислотно – основное титрование.
- •Дата_________ Лабораторная работа № ______
- •Определение массы гидроксида натрия в растворе
- •Расчеты:
- •Задания для самостоятельной работы
- •Химическая термодинамика. Энергетика химических реакций.
- •I начало термодинамики. Энтальпия. Закон Гесса. Дата_________ Лабораторная работа № ______ Определение стандартной энтальпии реакции нейтрализации.
- •Расчеты
- •Энтропия. Химическое равновесие. Задания для самостоятельной работы
- •Химическая кинетика. Дата_________ Лабораторная работа №________ Определение кинетических характеристик реакции окисления иодид-ионов пероксидом водорода.
- •Экспериментальные данные
- •Расчеты Вывод
- •Задания для самостоятельной работы
- •Расчеты
- •Экспериментальные данные
- •Расчеты:
- •Задания для самостоятельной работы
- •Теоретическое и экспериментальное определение рН. Дата_________ Лабораторная работа
- •Экспериментальные данные
- •Свойства буферных растворов. Дата_________ Лабораторная работа Свойства буферных растворов.
- •Экспериментальные данные
- •Расчет рН
- •Экспериментальные данные
- •Гетерогенные процессы. Дата_________ Лабораторная работа Гетерогенные равновесия в растворах электролитов
- •Расчет пс:
- •Расчет пс:
- •Дата_________ Лабораторная работа № _________ Построение изотермы адсорбции уксусной кислоты на угле.
- •Получение и устойчивость дисперсных систем. Дата_________ Лабораторная работа № ______
- •Адсорбция на подвижной и неподвижной границах раздела фаз. Получение и устойчивость дисперсных систем. Задания для самостоятельной работы
- •Ход работы:
- •Задания для самостоятельной работы
- •Дата_________ Лабораторная работа № _________
- •Задания для самостоятельной работы
- •Защита модуля 4 Механизмы реакций в органической химии
- •Биологически важные органические соединения неполимерного характера Дата_________ Лабораторная работа № _________ Свойства гетерофункциональных соединений.
- •Задания для самостоятельной работы
- •Выводы Задания для самостоятельной работы
- •Задания для самостоятельной работы
- •Строение и свойства аминокислот, пептидов и белков. Дата_________ Лабораторная работа № ________
- •Ход работы:
- •Занятие 29
- •Свойства растворов биополимеров
- •Дата_________ Лабораторная работа
- •Свойства растворов вмс. Определение изоэлектрической точки белка по степени набухания.
- •Дата_________ Лабораторная работа № _______ Строение и свойства углеводов
- •Дата_________ Лабораторная работа Нуклеиновые кислоты и их структурные компоненты
- •Дата_________ Лабораторная работа Изучение свойств липидов и их структурных компонентов
Задания для самостоятельной работы
1). В данных органических соединениях укажите реакционные центры, по которым возможно протекание реакций SN, АN, АN- Е.
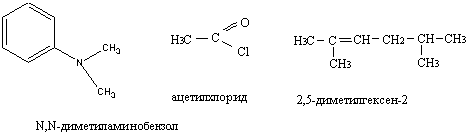
2) Укажите реакционные центры в молекуле новокаина

3) Выпишите структурные формулы адреналина, дофамина, тирозина (учебник, с.258), фумаровой кислоты (с.94), тимола (с.155) и антифебрина (с.205) . Укажите реакционные центры, их характер и сопряженную систему связей (если имеется) в этих молекулах.
4) Заполните схему реакции и укажите, по какому механизму она протекает.
R C=О
+R/NH2??
C=О
+R/NH2??
׀Н
R= -CH3, -H, -C2H5
R/= -C2H5, -OH, - NH2, -C6H5NH
Назовите реагент и конечный продукт реакции.
5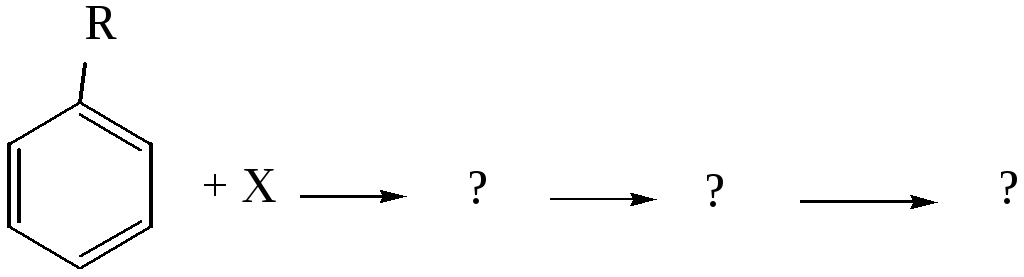 )
Заполните схему реакции и укажите, по
какому механизму она протекает.
)
Заполните схему реакции и укажите, по
какому механизму она протекает.
- комплекс σ – комплекс
![]()
Назовите конечный продукт по заместительной номенклатуре.
6) Назовите по систематической номенклатуре ИЮПАК и укажите функциональные группы в молекулах:

7) Напишите структурные формулы соединений. Укажите, к каким классам относятся соединения:
Ментол (2-изопропил-5-метилциклогексанол-1)
Кротоновая кислота (транс-бутен-2-овая кислота)
Ксилит (пентанпентаол-1,2,3,4,5)
Метионин (2-амино-4-метилтиобутановая кислота)
Ментан (1-изопропил-4-метилциклогексан)
Защита модуля 4 Механизмы реакций в органической химии
Дата _________
Ф.И.О. _______________________ группа _______ Билет № ________
Занятие 23
Биологически важные органические соединения неполимерного характера Дата_________ Лабораторная работа № _________ Свойства гетерофункциональных соединений.
Цель работы:Изучить кислотно-основные и хелатоообразующие свойства-гидрокси- кислот и-аминокислот.
Оборудование и реактивы: Пробирки, газовая горелка. Растворы: серной кислоты, гидроксида натрия (10%), гидроксида калия (5%), сульфата меди, хлорида железа (III), винной кислоты (все по 0,1 моль/л), глицина (5%), гидрокарбоната натрия (насыщенный), раствор брома в воде; этанол, фенол (5%), салициловая кислота, ацетилсалициловая кислота, молочная кислота.
Сущность работы:
Ход работы:
Опыт 1. Получение и свойства солей винной кислоты.
В первую пробирку помещают по 0,5 мл 15 % раствора винной кислоты и 5% раствора гидроксида калия. Пробирку интенсивно встряхивают и наблюдают постепенное выделение белого кристаллического осадка гидротартрата калия (если осадок не выпадает, внутреннюю стенку пробирки надо потереть стеклянной палочкой).
К полученному осадку добавляют по каплям 10 % раствор гидроксида натрия до полного его растворения, при этом образуется двойная калий-натриевая соль винной кислоты, называемая сегнетовой солью.
Во вторую пробирку помещают несколько капель раствора сульфата меди, добавляют раствор гидроксида натрия до выпадения голубого осадка. К выпавшему осадку гидроксида меди (II) добавляют раствор сегнетовой соли из первой пробирки. Отмечают изменение окраски раствора.
Уравнения реакций:
1)
2)
3)
Наблюдения:
Опыт 2. Свойства салициловой кислоты.
а) На предметное стекло помещают несколько кристаллов салициловой кислоты и добавляют одну каплю насыщенного раствора гидрокарбоната натрия. Наблюдают выделение газа.
б) В сухую пробирку помещают 2 лопаточки салициловой кислоты и осторожно нагревают нижнюю часть пробирки. При более энергичном нагревании происходит декарбоксилирование салициловой кислоты с образованием фенола, который обнаруживается по характерному запаху.
в) В две пробирки помещают по 1 лопаточке салициловой и ацетилсалициловой кислот, добавляют по 1 мл воды и к полученному раствору добавляют 1-2 капли бромной воды. Отмечают произошедшие изменения в каждой пробирке.
Уравнения реакций:
1)
2)
3)
Наблюдения:
Опыт 3. Гидролиз ацетилсалициловой кислоты.
В две пробирки помещают по несколько кристалликов ацетилсалициловой и салициловой кислот, добавляют в каждую пробирку по 0,5 мл воды и 2 капли раствора хлорида железа (III), отмечают окраску раствора в каждой пробирке. Раствор нагревают до кипения, отмечают изменение окраски раствора в каждом случае.
Уравнения реакций:
1)
2)
Наблюдения:
Опыт 4. Разложение молочной кислоты концентрированной серной кислотой.
В пробирку наливают 1 мл молочной кислоты и 1 мл концентрированной серной кислоты. Нагревают смесь до кипения.
Уравнения реакции (-гидроксикислоты под действием концентрированной серной кислоты расщепляются на муравьиную кислоту и альдегид (кетон)):
Наблюдения:
Опыт 5. Качественная реакция -гидроксикислот с хлоридом железа (III).
В пробирку помещают 0,5 мл раствора фенола и добавляют 1-2 капли 1%-ного раствора хлорида железа. Отмечают наблюдения. При добавлении к раствору 2 капель молочной кислоты происходит изменение окраски раствора. Это связано с тем, что -гидроксикислоты вытесняют фенол из комплексного фенолята с образованием лактата железа.
Уравнения реакций:
1)
2)
Наблюдения:
Опыт 6. Реакция аминокислот с хлоридом железа (III).
К 1 мл раствора глицина добавляют несколько капель 5% раствора хлорида железа (III). Раствор слегка нагревают до изменения окраски.
Уравнения реакций:
Наблюдения:
Выводы
Вопросы и задания к лабораторной работе:
1) Напишите схемы реакций образования гидротартрата и тартрата калия.
Наличие какого структурного фрагмента в винной кислоте доказывает реакция образования фелинговой жидкости?
2) Напишите уравнение реакции салициловой кислоты с гидрокарбонатом натрия. Наличие какой функциональной группы в салициловой кислоте доказывает эта реакция?
Какие кислотные центры присутствуют в молекуле салициловой кислоты? Сравните их силу (значения констант ионизации салициловой кислоты по первой ступени: К1= 1,110-3, по второй ступени: К2 = 2,610-14).
4) Напишите уравнение реакции салициловой кислоты с раствором брома.
5) Напишите уравнение реакции декарбоксилирования салициловой кислоты.
6) Приведите схему реакции гидролиза ацетилсалициловой кислоты.
Чем обусловлено появление фиолетовой окраски после добавления хлорида железа (III)?
Занятие 24
