
- •Московская Медицинская Академия им. И.М.Сеченова
- •Аттестационный лист студента
- •Основы количественного анализа. Способы выражения концентрации раствора.
- •Задания для самостоятельной работы
- •Основы количественного анализа.
- •Кислотно – основное титрование.
- •Дата_________ Лабораторная работа № ______
- •Определение массы гидроксида натрия в растворе
- •Расчеты:
- •Задания для самостоятельной работы
- •Химическая термодинамика. Энергетика химических реакций.
- •I начало термодинамики. Энтальпия. Закон Гесса. Дата_________ Лабораторная работа № ______ Определение стандартной энтальпии реакции нейтрализации.
- •Расчеты
- •Энтропия. Химическое равновесие. Задания для самостоятельной работы
- •Химическая кинетика. Дата_________ Лабораторная работа №________ Определение кинетических характеристик реакции окисления иодид-ионов пероксидом водорода.
- •Экспериментальные данные
- •Расчеты Вывод
- •Задания для самостоятельной работы
- •Расчеты
- •Экспериментальные данные
- •Расчеты:
- •Задания для самостоятельной работы
- •Теоретическое и экспериментальное определение рН. Дата_________ Лабораторная работа
- •Экспериментальные данные
- •Свойства буферных растворов. Дата_________ Лабораторная работа Свойства буферных растворов.
- •Экспериментальные данные
- •Расчет рН
- •Экспериментальные данные
- •Гетерогенные процессы. Дата_________ Лабораторная работа Гетерогенные равновесия в растворах электролитов
- •Расчет пс:
- •Расчет пс:
- •Дата_________ Лабораторная работа № _________ Построение изотермы адсорбции уксусной кислоты на угле.
- •Получение и устойчивость дисперсных систем. Дата_________ Лабораторная работа № ______
- •Адсорбция на подвижной и неподвижной границах раздела фаз. Получение и устойчивость дисперсных систем. Задания для самостоятельной работы
- •Ход работы:
- •Задания для самостоятельной работы
- •Дата_________ Лабораторная работа № _________
- •Задания для самостоятельной работы
- •Защита модуля 4 Механизмы реакций в органической химии
- •Биологически важные органические соединения неполимерного характера Дата_________ Лабораторная работа № _________ Свойства гетерофункциональных соединений.
- •Задания для самостоятельной работы
- •Выводы Задания для самостоятельной работы
- •Задания для самостоятельной работы
- •Строение и свойства аминокислот, пептидов и белков. Дата_________ Лабораторная работа № ________
- •Ход работы:
- •Занятие 29
- •Свойства растворов биополимеров
- •Дата_________ Лабораторная работа
- •Свойства растворов вмс. Определение изоэлектрической точки белка по степени набухания.
- •Дата_________ Лабораторная работа № _______ Строение и свойства углеводов
- •Дата_________ Лабораторная работа Нуклеиновые кислоты и их структурные компоненты
- •Дата_________ Лабораторная работа Изучение свойств липидов и их структурных компонентов
Расчеты:
Вывод:
Задания для самостоятельной работы
1) Вычислите объем раствора азотной кислоты с концентрацией 0,065 моль/л, необходимый для титрования раствора, содержащего 0,1 г гидроксида калия.
2) Раствор муравьиной кислоты массой 2,32 г разбавлен водой до 100 мл. На титрование 10 мл разбавленного раствора затрачено 7,2 мл раствора гидроксида калия с концентрацией 0,15 моль/л. Рассчитайте массовую долю муравьиной кислоты в исходном растворе.
Занятие 3.
Химическая термодинамика. Энергетика химических реакций.
I начало термодинамики. Энтальпия. Закон Гесса. Дата_________ Лабораторная работа № ______ Определение стандартной энтальпии реакции нейтрализации.
Цель работы: Научиться калориметрически определять энтальпии химических реакций.
Приборы, оборудование и реактивы: Лабораторный калориметр, термометр с ценой деления 0,1о, мерные цилиндры, растворы кислоты и основания.
Сущность работы:
Теплота реакции нейтрализации определяется калориметрически по измеренному изменению температуры и рассчитанной теплоемкости системы.
Лабораторный калориметр
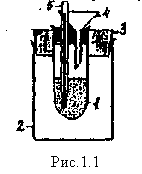
Энтальпия реакции нейтрализации, протекающей между сильными одноосновными кислотами и сильными однокислотными основаниями практически не зависит от их природы, так как реально в растворах протекает одна и та же реакция:
Н+(aq)+ ОН–(aq)= Н2О(ж);DН°r= -57,3 кДж/моль.
В случае реакции нейтрализации слабых кислот и слабых оснований такого постоянства не наблюдается, так как часть теплоты расходуется на ионизацию слабой кислоты и слабого основания.
Ход работы.
1. Измеряют температуру исходных растворов.
Мерным цилиндром переносят требуемый объем щелочи в колориметрический стакан и измеряют температуру раствора.
Мерным цилиндром отмеривают такой же объем кислоты и измеряют температуру
2. Измеряют максимальную температуру после сливания растворов.
Экспериментальные данные.
|
№ опыта |
Температура раствора, оС | ||
|
кислоты (исх) |
щелочи (исх) |
после нейтрализации | |
|
1 |
|
|
|
|
2 |
|
|
|
|
3 |
|
|
|
|
Среднее значение |
|
|
|
Концентрации растворов _____
Объемы растворов _____
Плотности растворов________________
Масса калориметрического стакана
Справочные величины
Суд(р-ра) = 4,184 Дж/г×К Суд(стекла) = 0,753 Дж/г×К
Обработка результатов эксперимента
Рассчитывают теплоемкость системы: С = С1+С2
Теплоемкость раствора С1рассчитывают по формуле:
С1=[V(к-ты)×r(к-ты) +V(осн.)×r(осн.)]×Суд(р-ра)
где V– объемы смешиваемых растворов, мл;r- плотность растворов, г/мл;
Суд(р-ра) – удельная теплоемкость раствора,
Теплоемкость стакана C2рассчитывают по формуле:
C2=m×Суд(стекла), гдеm– масса стакана, г; Суд(стекла) – удельная теплоемкость стекла,
Стандартную энтальпию реакции нейтрализации рассчитывают по формуле:
DН°r= -С×DТ/n
где DТ – разница между средним арифметическим значением температур после реакции и средним арифметическим значением температур до реакции;
n- количество вещества воды, образовавшейся в результате реакции.
Экспериментально определенную величину сравнивают со справочным значением, находят абсолютную и относительную ошибку определения:
Абсолютная ошибка: DН°теор–DН°эксп.
Относительная ошибка: ½DН°теор–DН°эксп½ /½DН°теор. ½
