
- •Московская Медицинская Академия им. И.М.Сеченова
- •Аттестационный лист студента
- •Основы количественного анализа. Способы выражения концентрации раствора.
- •Задания для самостоятельной работы
- •Основы количественного анализа.
- •Кислотно – основное титрование.
- •Дата_________ Лабораторная работа № ______
- •Определение массы гидроксида натрия в растворе
- •Расчеты:
- •Задания для самостоятельной работы
- •Химическая термодинамика. Энергетика химических реакций.
- •I начало термодинамики. Энтальпия. Закон Гесса. Дата_________ Лабораторная работа № ______ Определение стандартной энтальпии реакции нейтрализации.
- •Расчеты
- •Энтропия. Химическое равновесие. Задания для самостоятельной работы
- •Химическая кинетика. Дата_________ Лабораторная работа №________ Определение кинетических характеристик реакции окисления иодид-ионов пероксидом водорода.
- •Экспериментальные данные
- •Расчеты Вывод
- •Задания для самостоятельной работы
- •Расчеты
- •Экспериментальные данные
- •Расчеты:
- •Задания для самостоятельной работы
- •Теоретическое и экспериментальное определение рН. Дата_________ Лабораторная работа
- •Экспериментальные данные
- •Свойства буферных растворов. Дата_________ Лабораторная работа Свойства буферных растворов.
- •Экспериментальные данные
- •Расчет рН
- •Экспериментальные данные
- •Гетерогенные процессы. Дата_________ Лабораторная работа Гетерогенные равновесия в растворах электролитов
- •Расчет пс:
- •Расчет пс:
- •Дата_________ Лабораторная работа № _________ Построение изотермы адсорбции уксусной кислоты на угле.
- •Получение и устойчивость дисперсных систем. Дата_________ Лабораторная работа № ______
- •Адсорбция на подвижной и неподвижной границах раздела фаз. Получение и устойчивость дисперсных систем. Задания для самостоятельной работы
- •Ход работы:
- •Задания для самостоятельной работы
- •Дата_________ Лабораторная работа № _________
- •Задания для самостоятельной работы
- •Защита модуля 4 Механизмы реакций в органической химии
- •Биологически важные органические соединения неполимерного характера Дата_________ Лабораторная работа № _________ Свойства гетерофункциональных соединений.
- •Задания для самостоятельной работы
- •Выводы Задания для самостоятельной работы
- •Задания для самостоятельной работы
- •Строение и свойства аминокислот, пептидов и белков. Дата_________ Лабораторная работа № ________
- •Ход работы:
- •Занятие 29
- •Свойства растворов биополимеров
- •Дата_________ Лабораторная работа
- •Свойства растворов вмс. Определение изоэлектрической точки белка по степени набухания.
- •Дата_________ Лабораторная работа № _______ Строение и свойства углеводов
- •Дата_________ Лабораторная работа Нуклеиновые кислоты и их структурные компоненты
- •Дата_________ Лабораторная работа Изучение свойств липидов и их структурных компонентов
Задания для самостоятельной работы
1) Заполните таблицу
|
Функциональные группы
|
Название класса гетерофункциональных соединений |
Пример соединения
структурная формула название
| |
|
OH NH2
|
|
|
2-аминоэтанол (коламин) |
|
OH COOH
|
|
|
2-гидроксипропано вая (молочная) кислота |
|
NH2 COOH
|
|
|
2-аминопропано- вая кислота (глицин) |
|
COOH
|
|
|
2-оксопропановая (пировиноградная) кислота |
2) Обозначьте сопряженный фрагмент, укажите вид сопряжения в молекулах.
Укажите функциональные группы, назовите их.
Укажите соединения, относящиеся к полифункциональным; к гетерофункциональным.
Коричная кислота С6Н5СН=СНСООН
Сорбиновая кислота СН3СН=СНСН=СНСООН
Фумаровая кислота НООССН=СНСООН
![]()
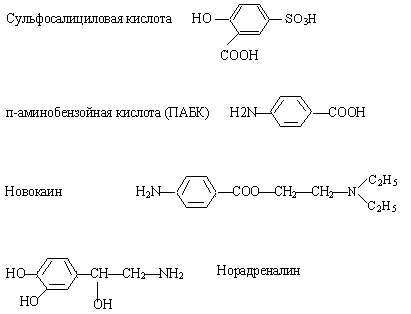
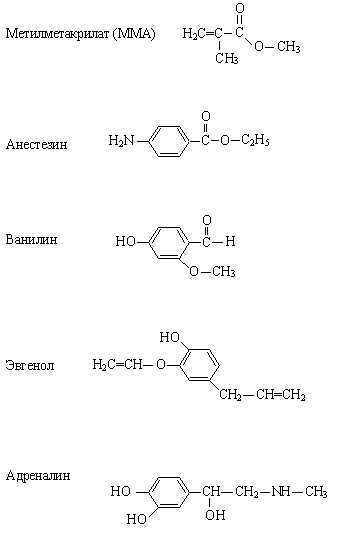
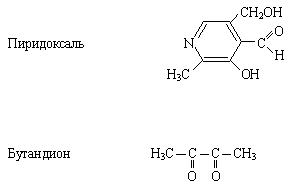
3) Напишите схемы образования и дайте название продукта:
циклического моноэфира -лактона из 4-гидроксибутановой (-гидроксимасляной) кислоты:
2) циклического моноамида -лактама из 4-аминобутановой (-аминомасляной) кислоты:
3) циклического сложного эфира лактида из 2-гидроксипропановой (молочной) кислоты:
Занятие 25
Общая теория редокс-процессов. Окислительно- восстановительные процессы в организме.
Дата_________ Лабораторная работа
Окислительно-восстановительные свойства веществ. Определение направления редокс-процесса.
Цель работы:Изучить окислительно-восстановительные свойства веществ. Научиться оценивать условия протекания окислительно-восстановительных реакций, прогнозировать направление процесса.
Оборудование и реактивы: Пробирки, газовая горелка. Растворы: серной кислоты, гидроксида натрия, бромида калия, иодида калия, сульфата меди, хлорида железа (III), перманганата калия, дихромата калия, иодата калия, уксусной кислоты (все по 0,1 моль/л); этанол, ацетон, формалин, щавелевая кислота.
Сущность работы:
Пользуясь величинами стандартных редокс-потенциалов, прогнозируют направление самопроизвольного протекания редокс процессов. Чем больше значение редокс–потенциала редокс–системы, тем выше ее окислительная способность, то есть тем сильнее окислитель и слабее сопряженный ему восстановитель.
Для определения направления самопроизвольного протекания редокс -процесса необходимо сравнить величины редокс - потенциалов двух редокс - систем. Окисленная форма той редокс-системы, потенциал которой больше, и будет выполнять роль окислителя в данном процессе. Разность потенциалов =(ox)(red) >0 свидетельствует, что процесс будет протекать самопроизвольно в прямом направлении.
Ход работы:
Отыт1. Определение направления редокс-процесса.
1. В две пробирки наливают по 0,5 мл раствора хлорида железа (III). В одну из них добавляют 10-15 капель иодида калия, в другую 10-15 капель раствора бромида калия.
Уравнения реакций:
Наблюдения:
Справочные данные: r(Fe3+/Fe2+) = ____________
r( Br2 /Br) = ______________ r( I2/I) = _____________
Расчеты:
2. В пробирку наливают по 0,5 мл растворов иодата калия и иодида калия, затем добавляют по каплям раствор серной кислоты до изменения окраски раствора. Наблюдают образование иода. К полученному раствору добавляют по каплям 10% раствор гидроксида натрия до исчезновения окраски иода.
Уравнения реакций:
Наблюдения:
Справочные данные:
2IO3 + 6H2O + 10ē I2 + 12OH, r = +0,21B
2IO3 + 12H+ + 10ē I2 + 6H2O, r = +1,19B
Расчеты:
Опыт 2. Окисление спиртов.
В пробирку помещают по 10 капель этанола и раствора дихромата калия, добавляют 5 капель серной кислоты. Нагревают полученный раствор над пламенем горелки до появления зелено-голубой окраски, одновременно ощущается характерный запах уксусного альдегида, напоминающий запах зеленых яблок.
Уравнения реакций:
Наблюдения:
Опыт 3. Окисление альдегидов.
В две пробирки наливают по 10 капель 10 % раствора гидроксида натрия, добавляют 5 капель раствора сульфата меди. К выпавшему голубому осадку гидроксида меди (II) добавляют в первую пробирку 10 капель раствора формальдегида, а во вторую – 10 капель ацетона.
Пробирки осторожно нагревают до кипения.
Уравнения реакций:
Наблюдения:
Опыт 4. Окисление щавелевой кислоты.
В первую пробирку помещают 1 лопатку щавелевой кислоты, во вторую – 0,5 мл раствора уксусной кислоты. В обе пробирки добавляют по 10 капель раствора перманганата калия и по 5 капель раствора серной кислоты. Нагревают обе пробирки над пламенем горелки.
Уравнения реакций:
Наблюдения:


 C=O
C=O