
- •Введение в органическую химию
- •3. Изомерия органических веществ
- •4. Особенности углерод-углеродных связей
- •5. Электронные эффекты в органических молекулах
- •1.4. Номенклатура органических соединений
- •Алифатические углеводороды
- •1. Предельные углеводороды (алканы)
- •1.1. Номенклатура и изомерия алканов
- •1.2. Методы получения алканов.
- •1.3. Химические свойства алканов
- •1.4. Применение алканов
- •2. Этиленовые углеводороды (алкены)
- •2.1. Номенклатура и изомерия алкенов
- •2.2. Способы получения алкенов
- •2.3. Химические свойства алкенов
- •2.4. Применение алкенов
- •3. Диены
- •3.1. Электронное строение сопряженных диенов
- •3.2.Химические свойства сопряженных диенов
- •3.3. Применение сопряженных диенов
- •3.4. Получение диенов
- •4. Углеводороды с одной тройной связью (алкины)
- •4.1. Номенклатура и изомерия алкинов
- •4.2. Методы получения алкинов
- •4.3. Химические свойства алкинов
- •4.4. Применение ацетилена
- •Ароматические углеводороды
- •Спирты и фенолы
- •2. Изомерия и номенклатура спиртов
- •3. Методы получения спиртов:
- •7. Фенолы
- •Карбонильные соединения (альдегиды и кетоны)
- •1. Классификация карбонильных соединений
- •3. Методы получения альдегидов и кетонов
- •4. Физические свойства
- •5. Химические свойства
- •5.1. Реакции присоединения:
- •5.3. Реакции с участием атома водорода в α-положении
- •5.4. Окисление альдегидов и кетонов
- •Карбоновые кислоты
- •1. Классификация карбоновых кислот
- •2. Номенклатура и изомерия
- •4. Физические свойства
- •5. Химические свойства
- •7.1. Жиры
- •Оксикислоты. Оксокислоты
- •1. Оптическая изомерия
- •1.1. Оптически активные соединения с одним асимметрическим атомом углерода.
- •1.2. Проекционные формулы Фишера
- •1.3. Оптически активные соединения с несколькими
- •1.4. Генетические ряды
- •2. Оксикислоты
- •2.2. Физические и химические свойства
- •3.Оксокислоты
- •4. Ацетоуксусный эфир. Таутомерия
- •Углеводы
- •I. Моносахариды
- •3. Альдозы. Изомерия. Генетические ряды
- •4. Циклические формы моносахаридов. Таутомерия.
- •5. Кетозы
Введение в органическую химию
План лекции
Предмет органической химии
Теория химического строения А. М. Бутлерова
Изомерия органических веществ
Особенности углерод-углеродных связей
Электронные эффекты в органических молекулах
Особенности органических реакций
Классификация органических веществ
Номенклатура органических веществ
Предмет органической химии
Органическая химия – это химия углеводородов и их функциональных производных.
Специфика углеводородов в сравнении с водородными соединениями других элементов заключается в особых свойствах атома углерода. Находясь в четвертой группе второго периода периодической системы, углерод при образовании химических связей не имеет на валентной оболочке ни электронных пар, ни вакантных орбиталей; это обстоятельство обусловливает высокую химическую устойчивость соединений. Кроме атомов углерода и водорода в состав органических соединений входят и другие атомы периодической системы – O, S, N, P, атомы галогенов и другие. Производные углеводородов, в которых один или несколько атомов водорода замещены на другие атомы или группы атомов (функциональные группы), называют функциональными производными.
Теория химического строения А, М. Бутлерова
Теория химического строения А. М. Бутлерова (1861) явилась фундаментом, на котором строилась теоретическая органическая химия. Основные ее положения в современной формулировке сводятся к следующему:
1) Атомы в молекулах соединены друг с другом в определенной последовательности в соответствии с их валентностью. Углерод во всех органических соединениях четырехвалентен.
Химические формулы, отражающие порядок соединения атомов, называют структурными:
H H H
 |
|
|
|
H — C — C — N
 |
|
|
|
H H H
Структурные формулы могут быть изображены и в сокращенном виде, например, CH3 − CH2 − NH2 или C2H5NH2.
2) Свойства веществ зависят не только от того, атомы каких элементов и в каком количестве входят в состав молекул, но и от последовательности соединения атомов в молекулах, т.е. от химического строения молекул.
3) Атомы или группы атомов, образующие молекулу, взаимно влияют друг на друга.
4) Строение молекул может быть установлено на основе изучения их химических свойств.
3. Изомерия органических веществ
Явление изомерии – наглядная иллюстрация второго положения теории А. М. Бутлерова.
Изомеры – вещества, имеющие одинаковый качественный и количественный состав, но различающиеся по строению, и, вследствие этого, по физическим и химическим свойствам.
Различают структурную и пространственную изомерию.
Структурная изомерия связана с различным порядком соединения атомов в молекулах. Разновидности структурной изомерии:
изомерия углеродного скелета
Этот тип изомерии обусловлен возможностью построения различных углеродных скелетов из n углеродных атомов, если n больше или равно четырем. Например, молекулярной формуле C4H10 соответствуют два вещества – бутан и 2-метилпропан (изобутан):
CH3−CH2−CH2−CH3 CH3−CH−CH3
бутан | 2-метилпропан
CH3
изомерия положения
Атомы или группы атомов (заместители), не входящие в состав скелета, могут быть соединены с различными углеродными атомами цепи:
Cl−CH2−CH2−CH2−CH3 CH3−CH−CH2−CH3
1-хлорбутан | 2-хлорбутан
Cl
К такому типу изомерии можно отнести изомерию, обусловленную различным положением кратных связей:
CH2=CH−CH2−CH3 CH3−CH=CH−CH3
бутен-1 бутен-2
межклассовая изомерия
Изомерами могут быть соединения, содержащие различные функциональные группы и относящиеся к различным классам органических соединений, например:
CH3−CH2−NO2 H2N−CH2−COOH
нитроэтан аминоуксусная кислота
Пространственная изомерия обусловлена различным расположением в пространстве атомов и групп атомов в молекулах с одинаковой последовательностью соединения атомов. Разновидности пространственной изомерии:
геометрическая изомерия
Этот вид изомерии характерен для соединений, содержащих двойную связь или цикл. В таких молекулах часто можно провести условную плоскость таким образом, что заместители у различных атомов углерода могут оказаться по одну сторону (цис-) или по разные стороны (транс-) от этой плоскости:



 H
H H3C
H
H
H H3C
H
C


 = C C = C
= C C = C
H3C CH3 H CH3
цис-бутен-2транс-бутен-2
оптическая изомерия
Оптическими изомерами называют молекулы, зеркальные изображения которых не совместимы друг с другом. Таким свойством обладают молекулы, имеющие асимметрический центр – атом углерода, связанный с четырьмя различными заместителями. Например, в виде двух оптических изомеров существует молекула молочной кислоты CH3−CH(OH)−COOH:
 H
H
H
H
| |
C
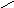
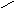
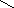

 C
C
HO CH3 H3C OH
COOH HOOC
