
- •Введение в органическую химию
- •3. Изомерия органических веществ
- •4. Особенности углерод-углеродных связей
- •5. Электронные эффекты в органических молекулах
- •1.4. Номенклатура органических соединений
- •Алифатические углеводороды
- •1. Предельные углеводороды (алканы)
- •1.1. Номенклатура и изомерия алканов
- •1.2. Методы получения алканов.
- •1.3. Химические свойства алканов
- •1.4. Применение алканов
- •2. Этиленовые углеводороды (алкены)
- •2.1. Номенклатура и изомерия алкенов
- •2.2. Способы получения алкенов
- •2.3. Химические свойства алкенов
- •2.4. Применение алкенов
- •3. Диены
- •3.1. Электронное строение сопряженных диенов
- •3.2.Химические свойства сопряженных диенов
- •3.3. Применение сопряженных диенов
- •3.4. Получение диенов
- •4. Углеводороды с одной тройной связью (алкины)
- •4.1. Номенклатура и изомерия алкинов
- •4.2. Методы получения алкинов
- •4.3. Химические свойства алкинов
- •4.4. Применение ацетилена
- •Ароматические углеводороды
- •Спирты и фенолы
- •2. Изомерия и номенклатура спиртов
- •3. Методы получения спиртов:
- •7. Фенолы
- •Карбонильные соединения (альдегиды и кетоны)
- •1. Классификация карбонильных соединений
- •3. Методы получения альдегидов и кетонов
- •4. Физические свойства
- •5. Химические свойства
- •5.1. Реакции присоединения:
- •5.3. Реакции с участием атома водорода в α-положении
- •5.4. Окисление альдегидов и кетонов
- •Карбоновые кислоты
- •1. Классификация карбоновых кислот
- •2. Номенклатура и изомерия
- •4. Физические свойства
- •5. Химические свойства
- •7.1. Жиры
- •Оксикислоты. Оксокислоты
- •1. Оптическая изомерия
- •1.1. Оптически активные соединения с одним асимметрическим атомом углерода.
- •1.2. Проекционные формулы Фишера
- •1.3. Оптически активные соединения с несколькими
- •1.4. Генетические ряды
- •2. Оксикислоты
- •2.2. Физические и химические свойства
- •3.Оксокислоты
- •4. Ацетоуксусный эфир. Таутомерия
- •Углеводы
- •I. Моносахариды
- •3. Альдозы. Изомерия. Генетические ряды
- •4. Циклические формы моносахаридов. Таутомерия.
- •5. Кетозы
2.2. Физические и химические свойства
Оксикислоты – кристаллические вещества, легко растворимые в воде. Они плавятся при значительно более высоких температурах, чем соответствующие предельные кислоты, и лучше растворяются в воде. Причина этого – большее количество водородных связей между молекулами оксикислот.
Благодаря акцепторному действию ОН-группы оксикислоты обладают более выраженными кислотными свойствами:
CH3−CH2−COOH CH3−CH−COOH
|
OH
Т. пл. = −22ºС Т. пл. = 18ºС
pKa = 4,88pKa = 3,87
Наличие в молекулах оксикислот карбоксильной и гидроксильной групп приводит к тому, что эти вещества вступают в реакции, свойственные как спиртам, так и кислотам. В то же время они обладают и специфическими свойствами.
Образование эфиров
Реакция этерификации может протекать как по карбоксильной, так и по гидроксильной группе:



 O
H2SO4
O
O
H2SO4
O


 HO−CH2−C
+ C2H5OH
HO−CH2−C
+ H2O
HO−CH2−C
+ C2H5OH
HO−CH2−C
+ H2O
OH OC2H5
этиловый эфир гликолевой кислоты
O
||
 HO−CH2−COOH
+ (CH3CO)2O
CH3−C−O−CH2−COOH
+ CH3COOH
HO−CH2−COOH
+ (CH3CO)2O
CH3−C−O−CH2−COOH
+ CH3COOH
ацетилгликолевая кислота
Деструкция α-оксикислот
При нагревании с разбавленной серной кислотой α-оксикислоты распадаются до альдегидов и муравьиной кислоты:

 H2SO4(разб.) O
H2SO4(разб.) O
R
 −CH−COOH
R−C
+ HCOOH
−CH−COOH
R−C
+ HCOOH
| H
OH
Дегидратация
Оксикислоты легко отщепляют воду, причем в зависимости от взаимного положения гидроксильной и карбоксильной групп образуются различные вещества.
α-оксикислоты при нагревании образуют циклические сложные эфиры – лактиды (от латинского названия молочной кислоты – acidum lacticum):












 R
O−H HO O R O
O
R
O−H HO O R O
O
 CH
C CH C
CH
C CH C
 |
|
| | + 2 H2O
|
|
| | + 2 H2O









 C
CH C
CH
C
CH C
CH


 O
OH H−O R O O
R
O
OH H−O R O O
R



 2 H2O
2 H2O
H+ (OH−)
Обратная реакция – гидролиз лактидов – один из способов получения α-оксикислот.
β-оксикислоты при нагревании отщепляют воду, образуя непредельные кислоты:
C H3−CH−CH2−COOH
CH3−CH=CH−COOH
+ H2O
H3−CH−CH2−COOH
CH3−CH=CH−COOH
+ H2O
| β-оксимасляная кротоновая кислота
OH кислота
γ- и δ-оксикислоты в свободном состоянии очень неустойчивы (существуют в виде солей). При действии на эти соли сильных кислот они переходят в пяти- и шестичленные внутренние сложные эфиры – лактоны:



 CH2—CH2
− H2O
CH2—CH2
CH2—CH2
− H2O
CH2—CH2


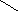




 CH2
C=O CH2
C=O
CH2
C=O CH2
C=O
 O−H
HO O
O−H
HO O
γ-оксимасляная кислота лактонγ-оксимасляной кислоты
