
- •1. Классы химических соединений
- •1.1. Оксиды
- •1.2. Гидроксиды
- •1.3. Соли
- •Домашнее задание № 1 Тема: Классы химических соединений
- •2. Электролиты
- •Тема: Электролиты
- •3. Гидролиз солей
- •3.1. Соли, образованные сильной кислотой и слабым основанием
- •3.2. Соли, образованные слабой кислотой и сильным основанием
- •4. Окислительно-восстановительные реакции (овр)
- •4.1. Степень окисления. Окислители и восстановители
- •4.2. Составление уравнений окислительно-восстановительных реакций
- •4.3. Взаимодействие металлов с растворами кислот
- •4.4. Взаимодействие металлов с водой
- •4.5. Взаимодействие металлов с водными растворами щелочей
- •Домашнее задание № 4 Тема: Окислительно-восстановительные реакции
- •5.Коррозия металлов
- •Домашнее задание № 5 Тема: Коррозия металлов
- •Примерный вариант итогового тестового задания. Часть а.
- •Часть в.
- •Часть с.
- •Часть в.
- •Часть с.
- •Методические указания
- •Неволина Ольга Алексеевна
5.Коррозия металлов
Коррозия металлов - это самопроизвольный окислительно-восстановительный процесс разрушения металла под действием окружающей среды.
|
Коррозия | |
|
Химическая |
Электрохимическая |
|
Возникает в отсутствии электролита: 2Fe + 3Cl2 = 2FeCl3; 4Al + 3O2 = 2Al2O3. |
Происходит в присутствии электролита и сопровождается возникновением микротоков в микрогальваноэлементах |
Пример 1. Рассмотрим процессы, происходящие при коррозии цинковой пластинки, склепанной с железной, в кислой среде. В этом случае образуется гальванопара ZnFe.
Выписываем окислительно-восстановительные потенциалы обоих металлов в данной среде по таблице (см.приложение 5):
0Zn2+/Zn = 0,76 B, 0Fe2+/Fe = 0,44 B;
Определяем по потенциалам более активный металл (с меньшим значением потенциала):
0Zn2+/Zn < 0Fe2+/Fe.
Более активный металл - Zn. Цинк разрушается в первую очередь, т.е. теряет электроны, является восстановителем
Zn0 2e Zn2+.
Второй металл (Fe) не разрушается, он является проводником электронов. e

ZnFe
HCl e
Окислителем является среда - кислая (ионы H+ принимают электроны), нейтральная (H2O) или щелочная (H2O). В нашем примере роль окислителя выполняют ионы H+.
Выписываем потенциал окислителя для кислой среды, имея в виду, что О2 в данном примере отсутствует
0 2Н+/Н2 = 0 В.
Процесс восстановления ионов водорода происходит на железе
на Fe: 2H+ + 2e H2.
Суммарный процесс при коррозии гальванопары ZnFe записываем в следующей форме: HСl
Zn0 2e Zn2+
на Fe: 1 2H+
+ 2e
H20
Zn0 + 2H+ = Zn2+ + H2
Молекулярное уравнение коррозии:
Zn0 + 2HCl = ZnCl2 + H2 (на Fe ).
Более активный металл является анодом (А), менее активный - катодом (К).
А() ZnFе К(+) ок > вос
HCl
коррозия возможна,
разрушается цинк.
Пример
2. Рассмотрим
коррозию латуни (сплава цинка и меди) в
щелочном растворе в присутствии
кислорода Zn
| Cu
NaOH+ H2O + O2.
Выписываем окислительно-восстановительные потенциалы обоих металлов в щелочной среде по таблице (см. приложение 5):
0ZnO22/Zn = 1,22 B, 0Cu(OH)2/Cu = 0,22 B.
Определяем по потенциалам более активный металл - Zn. Цинк разрушается в первую очередь, является восстановителем
Zn0 2e + 4OH ZnO22+ H2O.
Второй металл (Cu) не разрушается, он является проводником электронов . e

Zn
| Cu 
NaOH+
H2O
+ O2
e
Окислителем в данном примере может быть O2 и H2O. Выписываем потенциалы окислителей для щелочной среды из таблицы (см.приложение 5):
0
2H2O/H2
= 0,83
B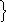
0 O2/4OH > 0 2H2O/H2.
0 O2/4OH= +0,40 B
Окислитель выбираем с большим потенциалом (O2).
Процесс восстановления кислорода происходит на меди
на Cu: O2 + 4e + 2H2O → 4OH.
Суммарный процесс при коррозии латуни в щелочной среде в присутствии кислорода записываем в следующей форме:
Zn0 2e + 4OH ZnO22+ H2O
на Сu: 1 O2 + 4e + 2H2O → 4OH
2Zn + 8OH + O2 + 2H2O 2 ZnO22+ 4H2O + 4OH
2Zn + 4OH + O2 2 ZnO22+ 2H2O.
Молекулярное уравнение коррозии:
2Zn + 4NaOH + O2 2Na2ZnO2 + 2H2O.
Более активный металл Zn - анод, Cu - катод
е

()А
Zn
| Cu
(+К) 
NaOH+
H2O
+ O2
e
ок > вос, коррозия возможна, разрушается цинк.
