
- •1. Классы химических соединений
- •1.1. Оксиды
- •1.2. Гидроксиды
- •1.3. Соли
- •Домашнее задание № 1 Тема: Классы химических соединений
- •2. Электролиты
- •Тема: Электролиты
- •3. Гидролиз солей
- •3.1. Соли, образованные сильной кислотой и слабым основанием
- •3.2. Соли, образованные слабой кислотой и сильным основанием
- •4. Окислительно-восстановительные реакции (овр)
- •4.1. Степень окисления. Окислители и восстановители
- •4.2. Составление уравнений окислительно-восстановительных реакций
- •4.3. Взаимодействие металлов с растворами кислот
- •4.4. Взаимодействие металлов с водой
- •4.5. Взаимодействие металлов с водными растворами щелочей
- •Домашнее задание № 4 Тема: Окислительно-восстановительные реакции
- •5.Коррозия металлов
- •Домашнее задание № 5 Тема: Коррозия металлов
- •Примерный вариант итогового тестового задания. Часть а.
- •Часть в.
- •Часть с.
- •Часть в.
- •Часть с.
- •Методические указания
- •Неволина Ольга Алексеевна
2. Электролиты
Электролиты - это вещества, распадающиеся на ионы в растворе под влиянием полярных молекул растворителя (H2O). Неэлектролиты не распадаются на ионы в растворе.
|
Электролиты |
Неэлектролиты |
|
1. Соли (Na2SO4) 2. Кислоты (HCl) 3.Основания(NaOH) |
1. Оксиды (SO3) 2. Простые вещества (металлы, неметаллы)–(Al, O2) 3.Органические вещества, кроме кислот и солей (спирт, глюкоза, крахмал) |
По склонности к диссоциации (распаду на ионы) электролиты условно делят на сильные и слабые. Сильные электролиты диссоциируют практически полностью (в разбавленных растворах), а слабые распадаются на ионы лишь частично.
К сильным электролитам относятся: см. табл.2.
К слабым электролитам относятся все остальные электролиты.
Таблица 2. СИЛЬНЫЕ ЭЛЕКТРОЛИТЫ.
|
Электролит |
Способ определения |
Справочные материалы |
|
Соли |
Практически все |
Таблица растворимости |
|
Кислоты |
H2SO4, HNO3, HClO4, HCl, HBr, HI |
Запомнить |
|
Щелочи |
образованы металлами IA и IIA подгрупп, кроме Be и Mg LiOH, NaOH, KOH, RbOH, CsOH Ca(OH)2, Sr(OH)2, Ba(OH)2 |
Периодическая система химических элементов Д.И.Менделеева |
Одной из основных характеристик слабого электролита является константа диссоциации–К.
Например, для одноосновной кислоты,
HAH++A-,
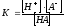 ,
,
где, [H+] – равновесная концентрация ионовH+;
[A-] – равновесная концентрация анионов кислоты А;
[HA] – равновесная концентрация молекул кислоты,
Или для слабого основания,
MеOHMе++OH- ,
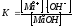 ,
,
где, [Mе+] – равновесная концентрация катионовMе+;
[OH-] – равновесная концентрация гидроксид- ионов ОН-;
[MеOH] – равновесная концентрация молекул слабого основания.
Правила составления уравнений диссоциации электролитов
1. а) При диссоциации сильных электролитов ставится знак “=“ (равенства). Этот знак обозначает полную диссоциацию.
б) Сильные электролиты диссоциируют нацело
2. а) При диссоциации слабых (и средней силы) электролитов -
знак “⇄“ (обратимости). Этот знак обозначает частичную диссоциацию.
б) Слабые электролиты диссоциируют по ступеням.
3. Средние соли диссоциируют нацело, кислые и средние – по ступеням.
|
С и л ь н ы е электролиты |
С л а б ы е электролиты
|
|
Основания: Ba(OH)2 = Ba2+ + 2OH .
Кислоты: HCl = H+ + Cl.
Соли:
анион слабой кислоты H2PO4 ⇄ H+ + HPO42; HPO42 ⇄ H+ + PO43.
растворимая катион слабого часть основания AlOH2+ ⇄ Al3+ + OH.
|
Основания: Fe(OH)2 ⇄ FeOH++OH 1 cтупень; Растворимая Часть FeOH+ ⇄ Fe2+ + OH 2 ступень. Кислоты: H2CO3 ⇄ H+ + HCO3 1 ступень; HCO3⇄ H+ + CO32 2 ступень. Амфотерные гидроксиды: 1. Zn(OH)2 ⇄ OH + ZnOH+; основание ZnOH+⇄ OH + Zn2+. 2. H2ZnO2 ⇄ H+ + HZnO2; кислота HZnO2 ⇄ H+ + ZnO22. Вода: H2O ⇄ H+ + OH. |
Правила написания ионных уравнений
В ионных уравнениях на ионы расписываются:
а) сильные кислоты;
б) щелочи;
в) растворимые соли., т.е.
все сильные электролиты с учетом коэффициентов (пользуясь таблицей растворимости), все остальное (слабые электролиты и неэлектролиты) оставляют в виде молекул.
Пример 1. Написать следующие уравнения реакций в молекулярной и ионной форме: 1. CaCO3 + HCl; 2.Bi2(SO4)3 + K2S; 3. Al(OH)3 + NaOH.
1. Молекулярное уравнение: CaCO3 + 2HCl = CaCl2 + H2CO3;
полное ионное уравнение: CaCO3 + 2H+ + 2Cl = Ca2+ + 2Cl + H2CO3;
сокращенное ионное уравнение: СaCO3 + 2H+ = Ca2+ + H2CO3.
2. Молекулярное уравнение: Bi2(SO4)3 + 3K2S = Bi2S3 + 3K2SO4;
полное ионное уравнение:2Bi3++ 3SO42+ 6K++3S2=Bi2S3+6K++3SO42;
сокращенное ионное уравнение: 2Bi3+ + 3S2 = Bi2S3.
3. Молекулярное уравнение: Al(OH)3 + NaOH = NaAlO2 + 2H2O;
полное ионное уравнение: Al(OH)3 + Na+ + OH = Na+ + AlO2 + 2H2O;
сокращенное ионное уравнение: Al(OH)3 + OH = AlO2 +2H2O.
Сокращенные ионные уравнения выражают химическую сущность реакции. Однако отдельно записанные сокращенные ионные уравнения являются общими для множества подобных реакций.
Пример 2. По заданному ионному уравнению написать молекулярное:
а) Mg2+ + SO32 = MgSO3;
По левой части ионного уравнения подбираем к каждому иону противоположный по знаку ион - так, чтобы вместе они образовали молекулу сильного электролита (см. табл.2): например к иону Mg2+ подобрали ион NO3, т.к. Mg(NO3)2 – сильный электролит; точно так же к иону SO32 подобрали ион K+ т.к. K2SO3 – сильный электролит; в итоге получаем
молекулярное уравнение: Mg(NO3)2+ K2SO3= MgSO3 + 2KNO3;
Проверка: Mg2+ +2NO3 +2K+ + SO32 = MgSO3 + 2K+ +2NO3;
Mg2+ + SO32 = MgSO3.
б) HSO3 + OH= SO32 + H2O; аналогично
молекулярное уравнение:
KHSO3 + KOH = K2SO3 + H2O;
Проверка: K+ + HSO3 + K+ + OH = 2K+ + SO32 +H2O;
HSO3 + OH = SO32 + H2O.
в) 4OH + Zn2+ = ZnO22 + 2H2O;
Mолекулярное уравнение:4NaOH + ZnCl2 = Na2ZnO2 + 2NaCl + 2H2O;
Проверка: 4Na+ + 4OH + Zn2+ + 2Cl = 2Na+ + ZnO22 + 2Na+ + 2Cl + 2H2O;
4OH + Zn2+ = ZnO22 + 2H2O.
Домашнее задание № 2
