
- •1. Классы химических соединений
- •1.1. Оксиды
- •1.2. Гидроксиды
- •1.3. Соли
- •Домашнее задание № 1 Тема: Классы химических соединений
- •2. Электролиты
- •Тема: Электролиты
- •3. Гидролиз солей
- •3.1. Соли, образованные сильной кислотой и слабым основанием
- •3.2. Соли, образованные слабой кислотой и сильным основанием
- •4. Окислительно-восстановительные реакции (овр)
- •4.1. Степень окисления. Окислители и восстановители
- •4.2. Составление уравнений окислительно-восстановительных реакций
- •4.3. Взаимодействие металлов с растворами кислот
- •4.4. Взаимодействие металлов с водой
- •4.5. Взаимодействие металлов с водными растворами щелочей
- •Домашнее задание № 4 Тема: Окислительно-восстановительные реакции
- •5.Коррозия металлов
- •Домашнее задание № 5 Тема: Коррозия металлов
- •Примерный вариант итогового тестового задания. Часть а.
- •Часть в.
- •Часть с.
- •Часть в.
- •Часть с.
- •Методические указания
- •Неволина Ольга Алексеевна
В4. Впишите цифру:
Сумма коэффициентов в сокращенном ионном уравнении реакции
между гидроксидом лития и хлоридом железа(II) равна ______.
Часть с.
С1. Напишите в молекулярной и ионной (полной и сокращенной) формах уравнения реакций для следующих превращений:
NaOH → Cr(OH)3 → Cr2(SO4)3 → CrCl3 → CrOHCl2
C2. Напишите в молекулярной и ионной формах уравнения
а) гидролиза соли K2SO3, укажите значение pH раствора этой соли;
б) совместного гидролиза солей AlCl3 и NaCN
C3. Составьте электронную схему и молекулярное уравнение реакций. Коэффициенты расставьте методом ионно-электронного баланса.
а) K2Cr2O7 + N2 + H2SO4 → Cr3+ + NO3- + …
б) Ca + H2SO4 (конц) →
С4. Используя потенциалы (см. таблицу ), укажите анод и катод гальванопары, рассчитайте ЭДС, напишите уравнения анодного и катодного процесса, молекулярное уравнение коррозии алюминия в контакте с медью во влажной атмосфере.
ОТВЕТЫ.
Часть А.
А1
А2
А3
А4
А5
А6
А7
А8
А9
А10
А11
А12
2
3
3
2
4
2
1
4
4
1
4
3
Часть в.
В1
В2
В3
В4
2346
1245
АБГД
4
Часть с.
С1. NaOH → Cr(OH)3 → Cr2(SO4)3 → CrCl3 → CrOHCl2
1) 3NaOH + CrCl3 → 3NaCl + Cr(OH)3↓
3Na+ + 3OH- + Cr3+ + 3Cl- → 3Na+ + 3Cl- + Cr(OH)3↓
Cr3+ + 3OH-→ Cr(OH)3↓
2) 2Cr(OH)3 ↓ + 3H2SO4 → Cr2(SO4)3 + 6H2O
2Cr(OH)3↓ + 6H+ + 3SO42- → 2Cr3+ + 3SO42- + 6H2O
Cr(OH)3↓ + 3H+ → Cr3+ + 3H2O
3) Cr2(SO4)3 + 3BaCl2 → 2CrCl3 + 3BaSO4↓
2Cr3+ + 3SO42- + 3Ba2+ + 6Cl- → 2Cr3+ + 6Cl- + 3BaSO4↓
Ba2+ + SO42- → BaSO4↓
4) CrCl3 + NaOH → CrOHCl2 + NaCl
Cr3+ + 3Cl- + Na+ + OH- → CrOHCl2 + Na+ + Cl-
Cr3+ + 2Cl- + OH- → CrOHCl2
C2. a) K2SO3 = 2K+ + SO32-
Гидролизу подвергается анион слабой кислоты SO32-:
1-я ступень:
SO32-+HOH⇄HSO3-+OH-(ионыOH-в избытке).
Молекулярное уравнение 1-й ступени:
K2SO3 + H2O ⇄ KHSO3 + KOH – щелочная среда (рН 7)
б) AlCl3=Al3++ 3Cl-– гидролиз по катиону
NaCN=Na++CN-– гидролиз по аниону
Итоговое ионное уравнение:
Al3++ 3CN-+ 3H2O=Al(OH)3+ 3HCN
Молекулярное уравнение:
AlCl3 + 3NaCN+ 3H2O=Al(OH)3+ 3HCN+ 3NaCl
C3. a) K2Cr2O7 + N2 + H2SO4 Cr3+ + NO3- + …
среда
2K+ + Cr2O72- + N2 + 2H+ + SO42- Cr3+ + NO3- + …
5
10
Cr2O72+14Н+- +6е 2Cr3+ + 7Н2О
3
6
N2 + 6Н2О –10е 2NO3- + 12Н+
5Cr2O72-+ 3N2+70Н++18Н2О10Cr3++ 6NO3-+ 36Н++35Н2О
5Cr2O72-+ 3N2+ 34Н+10Cr3++ 6NO3-+ 17Н2О
10K++5Cr2O72-+3N2 + 34Н+ +17SO42- 10Cr3+ + 6NO3- + 10K++ 17SO42+ 17Н2О
5K2Cr2O7 + 3N2 +17H2SO4 5Cr2(SO4)3 + 6KNO3 + 2K2SO4 + 17Н2О
б) Ca+H2SO4 (конц) → …т.к.Caактивный металл, то
Ca + H2SO4 (конц) → CaSO4 + H2S + H2O
среда
Ca + 2H+ + SO42- Ca2+ + H2S + …
1
2
SO42-+8е +10Н+H2S+ 4Н2О
4
8
Ca –2е Ca2+
SO42-+ 4Ca + 10Н+ H2S + 4Ca2+ + 4Н2О
4SO42- + SO42-+ 4Ca + 10Н+ + 4Ca2+ + 4SO42- + 4Н2О
4Ca + 5H2SO4 (конц)→ 4CaSO4 + H2S + 4Н2О
Al
Cu
H2O + O2
C4.
Выписываем окислительно-восстановительные потенциалы обоих металлов в нейтральной среде по таблице (см приложение 5)
( Al(OH)3/Al)= -1,88В,
(Cu(OH)2/Cu) = +0,19В.
Более активный металл – Al, восстановитель.
Al0– 3e+ 3OH-Al(OH)3
Cuне разрушается, является проводником электронов
е

Al

Cu
H2O + O2
Окислителем в данном примере может быть O2иH2O.
(2Н2О/Н2) = -0,41 В
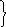
(О2/4OH-)(2Н2О/Н2).
(О2/4OH-) = +0,81 В
Окислитель - О2.
Процесс восстановления кислорода происходит на меди:
на Cu: O2 + 4e + 2H2O 4OH-
Суммарный процесс
4
Al0 – 3e + 3OH- Al(OH)3
На Cu:3
O2 + 4e + 2H2O 4OH-
4Al0 + 12OH- + 3O2 + 6H2O 4Al(OH)3 + 12OH-
4Al + 3O2 + 6H2O 4Al(OH)3
Молекулярное уравнение коррозии:
4Al + 3O2 + 6H2O 4Al(OH)3
Более активный металл Al– анод, Cu – катод:
е


А( -)Zn
Cu К( +)
H2O+O2
