
контроль качества и безопасность ЛП
.pdfСрок хранения ЛС должен быть научно обоснован методами исследования процессов разрушения его компонентов при хранении. Для этого часто используют условия ускорен- ного определения стабильности, создаваемые в термостате, поскольку процессы разложе- ния ЛС при обычных условиях протекают медленно (от 2 до 5 лет). Исследования кинетики реакций разложения ЛВ проводят при повышенных температурах (40–100°С) в течение 15– 120 дней, отмечая изменения физико-химических свойств вещества. Используя факторы ускоряющего воздействия на протекание химических реакций (свет, влажность, рН среды, присутствие окислителей и др.), в течение относительно короткого промежутка времени устанавливают количественные изменения состава ЛС и определяют оптимальные парамет- ры условий хранения ЛС. Так, при испытаниях определяют температуру хранения ЛВ, обеспечивающую требуемый срок годности (расчеты проводят на основании уравнения Ар- рениуса, выражающего зависимость скорости реакции от температуры).
Для тех лекарственных препаратов, которые используются уже давно, сохранность ак- тивных субстанций проверялась неоднократно и сроки годности установлены окончатель- но. Для новых лекарственных препаратов время хранения устанавливается на основании ограниченных испытаний и должно быть подтверждено на практике. В процессе хранения в специализированных аналитических лабораториях проводится химическое определение сохранности активных субстанций всех лекарственных препаратов. В результате таких исследований срок годности лекарственных препаратов может быть изменен.
Следует подчеркнуть, что установленные сроки хранения для готовых лекарственных препаратов предполагают складское хранение, т.е. хранение в помещении с невысокой постоянной температурой и соответствующей влажностью.
В течение многих лет для определения стабильности лекарств использовался так на- зываемый классический метод. Сущность его заключается в том, что ЛС в течение перио- да, отводимого на его реакцию (обычно от 2 до 5 лет), хранят при комнатной температуре. Через определенные промежутки времени оценивают качество хранящегося лекарства по ФС или ВФС. На основании анализа делают заключение об оптимальном сроке хранения.
Основной недостаток таких испытаний заключается в том, что на их проведение ухо- дит несколько лет. Используемые в настоящее время методы исследования стабильности ЛС основаны на определении их качества в условиях ускоренных испытаний.
Методы ускоренного хранения (ускоренного старения) позволяют за 15-115 дней при 40-70оС установить сроки хранения, которые, как правило, совпадают с результатами, по- лученными при хранении ЛВ при комнатной температуре в течение 3-5 лет. Исследования ведут в климатических шкафах или комнатах, которые имеют устройства, позволяющие автоматически регулировать заданные условия хранения: температуру, влажность, свет. Оценку стабильности осуществляют, исследуя физические и химические изменения веще- ства.
Таким образом, методы ускорения старения основаны на изучении кинетики реакций разложения ЛВ. Используя факторы, ускоряющие химические реакции (температуру, свет, влагу, рН среды, кислород), можно в течение короткого промежутка времени количест- венно установить те изменения, которые происходят с лекарством при длительном хране- нии. Из перечисленных факторов чаще всего используют температуру. На основе полу- ченных результатов устанавливают оптимальные параметры хранения лекарств: темпера- турный режим, влажность, освещенность, рН среды, характер упаковки и т.д.
Цель исследования стабильности лекарств методами ускоренного хранения может быть различной. Если исследуется ЛВ (субстанция), то устанавливают влияние температуры, света и других факторов на процесс разложения (скорость химических реакций). Для ЛФ также устанавливают влияние вспомогательных веществ, стабилизаторов и других компо- нентов на стабильность.
Выполнение исследований методом ускоренного старения осуществляют, запаивая образцы в стеклянные трубки или ампулы в количестве, необходимом для однократного испытания. При изучении влияния на стабильность ЛВ атмосферного кислорода выпол- няют сравнительные испытания при одинаковой температуре, но помещая одну порцию испытуемого вещества в открытый сосуд, а другую – в запаянную ампулу, из которой вы-
151
теснен воздух.
В течение всего эксперимента необходимо строгое соблюдение температурного ре- жима. Для этого используют ультратермостаты, позволяющие поддержать температуру на заданном уровне с точностью ±0,2–1оС. При повышении температуры, как правило, уско- ряются протекающие в ЛС физико-химические процессы. Зависимость скорости реакции от температуры лежит в основе ускоренных методов старения и определяется либо прави- лом Вант-Гоффа, либо уравнением Аррениуса.
Наиболее простая методика определения сроков годности ЛВ и ЛФ изотермическим методом основана на использовании правила Вант-Гоффа: при повышении температуры на 10оС скорость химической реакции возрастает в 2–4 раза. Это правило справедливо только для реакций, протекающих в сравнительно небольшом температурном интервале. Поскольку для установления сроков хранения обычно используют температурный интер- вал 10оС и ведут исследования при температуре от 40 до 70оС, то правило Вант-Гоффа оказывается вполне приемлемым. Тара и упаковка при проведении исследований должны соответствовать требованиям НД.
Испытуемое ЛС в заводской упаковке подвергают воздействию температур, повы- шающих среднюю температуру его хранения. При этом сокращается промежуток време- ни, в течение которого происходят физические и химические процессы, приводящие к разрушению ЛВ в обычных условиях хранения до допустимых пределов (10%). При удач- ном подборе температурного интервала изменяются практически те же контролируемые показатели качества ЛВ, что и в условиях обычного хранения, но в значительно меньшем интервале времени. Это искусственное моделирование дает возможность в более короткие промежутки времени установить сроки хранения ЛС при 20-25оС. Кроме того, метод по- зволяет решать и другую задачу – найти температуру хранения, обеспечивающую задан- ный срок годности (для препаратов, имеющих ограниченный срок годности при комнат- ной температуре).
Как правило, предельные температуры экспериментального хранения для индивиду- альных ЛВ, таблеток, капсул (при высокой термической устойчивости этих ЛС она может быть и выше) составляют 60оС, для инъекционных растворов – 60оС, для мазей, линимен- тов, шприц-тюбиков – 40оС, для суппозиториев и аэрозолей – 30оС. При проведении ис- пытаний влияние света на испытуемые образцы должно быть исключено.
Срок годности С при температуре хранения Тхр связан с экспериментальным сроком годности Сэ при температуре экспериментального хранения Тэ зависимостью
С = К·Сэ,
где К – коэффициент соответствия, равный
К = А(Тэ–Тхр)/10
Исходя из правила Вант-Гоффа температурный коэффициент скорости химической реакции А при увеличении температуры на 10оС равен 2. Отсюда легко рассчитать вели- чину К при различных значениях разности Тэ-Тхр (табл. 12).
Таблица 12. Коэффициент соответствия срока годности при температуре хранения и экспериментального
срока годности при температуре экспериментального хранения
Тэ–Тхр, оС |
10 |
20 |
30 |
40 |
50 |
60 |
70 |
|
|
|
|
|
|
|
|
К |
2 |
4 |
8 |
16 |
32 |
64 |
128 |
|
|
|
|
|
|
|
|
Условия и порядок проведения экспериментов по установлению сроков годности за- ключаются в следующем. Эксперименты выполняются в термостатах при такой возможно более высокой температуре в интервале 50-100оС, которая должна обеспечивать получе- ние результатов по установлению сроков годности в самые короткие промежутки време-
152
ни. Однако при этой температуре не должны происходить необратимые изменения агре- гатного состояния ЛС или разрушения упаковки.
Определение срока годности должно проводиться не менее чем на трех сериях ЛС. При этом температура экспериментального хранения должна превышать среднюю темпе- ратуру хранения не менее чем на 10оС.
Оценка качества испытуемых образцов должна проводиться по показателям НД (ФС, ВФС). Показатели качества определяют через промежутки времени, эквивалентные шести месяцам хранения при обычных условиях (для данного ЛС). Периодичность контроля при А = 2 (табл. 13).
Таблица 13. Периодичность контроля в зависимости от разницы температуры экспериментального хранения и температуры хранения
Тэ–Тхр, оС |
10 |
20 |
30 |
40 |
50 |
60 |
70 |
|
|
|
|
|
|
|
|
|
|
Периодичность |
92 |
46 |
23 |
11 |
6 |
2,9 |
1,4 |
|
контроля, сут. |
||||||||
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
Количество ЛС, предназначенное для экспериментального хранения при каждой из выбранных температур, должно быть достаточным для выполнения шести параллельных испытаний. Началом экспериментального хранения считается момент помещения ЛС в термостат, а окончанием – либо завершение эксперимента, либо тот его период, когда ЛС перестает соответствовать требованиям НД (ФС, ВФС). Предельные сроки эксперимен- тального хранения при различных температурах соответствуют трех- или пятилетнему сроку обычного хранения при результатах экспериментального хранения, представленых в табл. 14.
Таблица 14. Предельные сроки экспериментального хранения при различных температурах, соответствующие трех- или пятилетнему сроку обычного хранения
Тэ–Тхр, оС |
10 |
20 |
30 |
40 |
50 |
60 |
70 |
|
|
|
|
|
|
|
|
|
|
Срок хране- |
548 |
274 |
137 |
68 |
34 |
17 |
8,6 |
|
ния 3 года |
||||||||
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
Срок хране- |
913 |
456 |
228 |
114 |
57 |
29 |
14,3 |
|
ния 5 лет |
||||||||
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
Для вычисления срока годности экспериментальный срок хранения умножают на ко- эффициент соответствия. Из рассчитанных значений (при различных Тэ–Тхр) вычисляют среднеарифметическое. При их расхождении более чем на 180 суток срок годности, най- денный при более высокой температуре, отбрасывают. Если сроки годности, установлен- ные на различных сериях ЛС, отличаются не более чем на 60 суток, усреднение проводят обычным путем или за срок годности принимают минимальное из полученных значений.
Пользуясь результатами эксперимента, можно рассчитать также температуру хране- ния, которая позволяет обеспечивать заданный срок годности. Для этого используют фор- мулу
Тхр = 20+10/lgАС20о/С
или
Тхр = Тэ+10/lgАСэ/С
За максимальную теоретически допустимую температуру хранения (Тmax) принимает- ся температура, при которой срок годности ЛС равен 3 годам. Рассчитывают ее, исходя из срока годности при 20оС по формуле
Тmax = 20+10/lgA·lg С20о/3·365,
153
где С20о – срок годности при 20оС, сут; 3 · 365 – трехлетний срок годности, сут. Результаты расчета Тmax при А=2 соответствуют данным, приведенным в табл. 15.
Таблица 15. Результаты расчета теоретически допустимой
температуры хранения |
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
С20о,сут. |
180 |
270 |
365 |
548 |
730 |
1095 |
1460 |
1865 |
2190 |
2920 |
4380 |
|
|
|
|
|
|
|
|
|
|
|
|
Тmax, оС |
–6 |
0 |
4 |
10 |
14 |
20 |
24 |
27 |
30 |
34 |
40 |
|
|
|
|
|
|
|
|
|
|
|
|
Методы ускоренного старения, основанные на использовании уравнения Аррениуса, в зависимости от способа термостатирования делятся на изотермические и неизотермиче- ские. Суть изотермического метода, как и при использовании правила Вант-Гоффа, сво- дится к экспериментальному определению констант скорости химической реакции для нескольких фиксированных температур. Выбор последних осуществляют с таким расче- том, чтобы скорость протекающей реакции была приемлемой для выполнения экспери- мента. С учетом порядка реакции рассчитывают время, в течение которого концентрация активного вещества уменьшается на 10% при условии, что продукты разложения не ток- сичнее исходного соединения. Этот период времени принимают за срок годности данного лекарства. Для выполнения испытаний изотермическим методом необходимо предвари- тельно доказать идентичность процесса разложения при различных температурах.
Зависимость скорости реакции от температуры определяется уравнением Аррениуса:
lgK = lgA – E/2,303RT,
где K – константа скорости при некоторой температуре; А – эмпирическая константа; Е – энергия активации, кДж/моль; R – молярная газовая постоянная, равная 8,314 Дж/(моль·К); Т – абсолютная температура.
Многочисленными экспериментами установлено, что уравнение Аррениуса с доста- точной точностью описывает зависимость скорости реакции от температуры в широком температурном интервале для реакций различных порядков.
Определение сроков годности ЛС с помощью уравнения Аррениуса осуществляют, выполняя следующие операции:
1.Определение константы скорости разложения ЛС и порядка реакции, которые уста-
навливают экспериментально по трем-четырем значениям температуры (обычно в интер- вале от 40 до 70оС). Для этого из смеси ЛВ (с известной начальной концентрацией) и про- дуктов его разложения через определенные промежутки времени отбирают пробы. В каж- дой из них определяют концентрацию испытуемого вещества и подставляют это значение
вуравнения для констант скоростей реакций различных порядков. На основании сделан- ных вычислений устанавливают, в каком из уравнений полученная величина будет иметь постоянное значение. Постоянство значений констант скорости указывает на пригодность того или иного уравнения и соответственно на порядок реакции. Затем производят вычис- ление среднего значения констант скоростей при всех температурах опыта.
2.Построение графика зависимости в аррениусовых координатах «–lg K» – «f (1/T)». Используя полученные значения K при различных температурах, строят график зависимо- сти между логарифмом константы скорости реакции (–lgK) и обратным значением абсо-
лютной температуры (1/Т). Прямолинейная зависимость графика позволяет путем экстра- поляции определить значения lgK для 20оС (или другой заданной температуры) с после- дующим вычислением значения константы скорости K.
Константу скорости реакции разложения лекарственного препарата можно рассчитать не только по графику, но и по выведенной из уравнения Аррениуса формуле:
lgKT2/KT1=E/2,303R(1/T1–1/T2),
где KT2 и KT1 – константы скорости реакции при температурах Т2 и Т1.
Определив константу скорости реакции при более высокой температуре Т2, можно рас-
154
считать константу скорости для комнатной (или другой заданной) температуры Т1. При расчетах исходят из предположения, что энергия активации Е для данной реакции не зави- сит от температуры (или меняется незначительно).
3. Расчет энергии активации Е процесса разложения исследуемого препарата и вычис- ление эмпирической константы А уравнением Аррениуса. По двум константам скорости реакции K1 и K2 (при условии, что K1>K2), соответственно установленным при двух раз- личных температурах Т1 и Т2(Т1>Т2), вычисляют энергию активации Е:
Е=(lg(K1/K2)·2,303R)/(1/T2-1/T1)
Константу А вычисляют с помощью видоизмененного уравнения Аррениуса:
lgA = lgK + E/( 2,303RT).
4. По найденному значению K рассчитывают время t, в течение которого происходит разложение ЛВ при 20оС (или другой заданной температуре). Если процесс представляет собой химическую реакцию первого порядка, расчет ведут по уравнению
t=2,303/К·lgСо/Сt
Таким образом, методы ускоренного определения сроков годности ЛВ основаны на изучении кинетики реакций разложения ЛВ при повышенной температуре и контроле ос- вещенности, влажности, рН среды, кислорода в воздухе. Применение такого подхода по- зволяет в течение короткого промежутка времени установить оптимальные параметры хранения лекарств.
155
10. БИОФАРМАЦЕВТИЧЕСКИЙ АНАЛИЗ
Биофармацевтический анализ – один из видов фармацевтического анализа. Его зада- чей является разработка методов выделения, очистки, идентификации и количественного определения ЛВ и их метаболитов в биологических жидкостях (моче, слюне, крови, плаз- ме или сыворотке крови и др.). Только на основе применения таких методик анализа мож- но выполнять биофармацевтические исследования, т.е. изучать вопросы всасывания, транспорта и выведения ЛВ, его биологическую доступность, процессы метаболизма. Все это дает возможность предупреждать возможное токсическое воздействие лекарств, раз- рабатывать оптимальные режимы фармакотерапии и контролировать процесс лечения. Особенно важно определять в биологических жидкостях концентрацию тех ЛВ, которые наряду с терапевтическим эффектом проявляют токсичность или недостаточно четко вы- раженное терапевтическое действие. Необходимо также контролировать содержание ЛВ в биологических жидкостях больных, особенно при желудочно-кишечных заболеваниях и заболеваниях печени и почек, так как при них изменяются процессы всасывания, наруша- ются метаболические процессы и замедляется выведение ЛВ из организма.
Биологические жидкости – очень сложные объекты для выполнения анализа. Они представляют собой многокомпонентные смеси, включающие очень большое число неор- ганических и органических соединений различной химической структуры: микроэлемен- ты, аминокислоты, полипептиды, белки, ферменты и др. Их концентрация колеблется от 10 мг/мл до нескольких нанограммов. Даже в такой относительно простой физиологиче- ской жидкости, как моча, идентифицировано несколько сотен органических соединений. Причем биологический объект – весьма динамичная система. Ее состояние и химический состав зависят от индивидуальных особенностей организма, воздействия факторов внеш- ней среды (состава пищи, физической и психической нагрузки и т.д.). Все это еще в боль- шей степени усложняет выполнение биофармацевтического анализа, так как на фоне столь большого количества сложных по химическому строению органических веществ нужно определять нередко очень малые концентрации ЛВ. Вводимые в биологические жидкости лекарственные препараты в процессе биотрансформации образуют метаболиты, количество которых нередко исчисляется несколькими десятками. Выделение этих ве- ществ из сложных смесей, разделение на индивидуальные компоненты и установление химического состава – трудная задача.
Можно выделить следующие особенности биофармацевтического анализа:
–объекты исследования представляют собой многокомпонентные смеси соединений, сходных по своей химической структуре;
–количества определяемых веществ, как правило, исчисляются микрограммами и даже нанограммами;
–исследуемые ЛВ и их метаболиты находятся в среде, состоящей из большого числа природных соединений (белков, ферментов и др.), которые могут обратимо или необрати- мо удерживать исследуемые вещества;
–условия выделения, очистки и анализа исследуемых веществ зависят от вида биологи- ческой жидкости, подвергаемой исследованию.
Помимо теоретического значения, которое имеют исследования в области биофарма- цевтического анализа для изучения вновь создаваемых лекарств, несомненна и практиче- ская роль этого раздела фармацевтического анализа. Знания в области биофармацевтиче- ского анализа необходимы клиническому биохимику и фармакологу для корректировки терапевтических доз в процессе лечения, изучения всевозможных взаимодействий ЛВ с органами и системами организма человека, а также проведения фармакокинетических ис- следований. Биофармацевтический анализ представляет собой своеобразный инструмент для проведения биофармацевтических исследований.
Большое значение имеет выбор метода для проведения биофармацевтического анали- за. Он должен иметь высокую чувствительность, возможность работы с малыми объемами проб, большую специфичность и избирательность, отличаться быстротой выполнения анализа, простотой подготовки анализируемых проб, несложностью обслуживания анали-
156
тического прибора, надежностью и воспроизводимостью метода, его универсальностью (пригодностью для анализа различных ЛВ), малой трудоемкостью, большой производи- тельностью и возможностью автоматизации процесса. Все это важно как при проведении терапевтического мониторинга у постели больного в клинических условиях, так и при проведении клинико-фармакокинетических исследований.
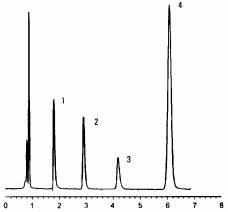
Требованиям, предъявляемым к биофармацевтическому анализу, отвечают современ- ные физико-химические методы анализа. При этом содержание ЛВ и их метаболитов в крови, а в ряде случаев и в слюне определяют с помощью хроматографических, иммуно- ферментных, спектрофлуориметрических методов, которые позволяют за несколько ми- нут получить необходимую информацию. Например, содержание антидепрессантов и их метаболитов в крови можно установить методом ВЭЖХ (рис. 19).
Содержание вещества в крови является важной мерой его терапевтического или токси- ческого действия. Так, величины токсических концентраций в крови для лекарственных препаратов различных фармакологических групп могут различаться на несколько поряд- ков (табл. 16).
При изучении поведения ЛВ в организме используются данные о концентрации препа- ратов или их метаболитов в биологических пробах в определенные моменты времени по- сле приема пациентами дозы лекарства. При этом сложность организма человека как фи- зико-химической системы не исключает возможности нахождения усредненных кинети- ческих параметров, позволяющих оценивать механизм изучаемых реакций с помощью применения математических моделей.
Рис. 19. Хроматограмма антидепрессантов: 1 – дезипрамина; 2 – имипрамина; 3 – амитриптилина; 4 – 2-оксиимизина
Таблица 16. Терапевтические, токсические и летальные |
|
|
|||
|
концентрации некоторых лекарств в крови |
|
|
||
|
|
|
|
|
|
|
Лекарственное |
Концентрации, мг/л |
|
||
|
вещество |
Терапевтическая |
|
Токсическая |
Летальная |
|
Парацетамол |
10–20 |
|
400 |
1500 |
|
Аспирин |
20–100 |
|
150–300 |
500 |
|
Фенобарбитал |
10 |
|
40–60 |
80–150 |
|
Аминазин |
0,5 |
|
1–2 |
3–12 |
|
Димедрол |
0,06–0,14 |
|
1–8 |
9,2 |
|
Нитразепам |
0,04–0,12 |
|
0,2 |
2,9–5,0 |
Типичные кривые изменения концентрации ксенобиотиков в крови, полученные при помощи методов биофармацевтического анализа, приведены на рис. 20. Эти кривые ха- рактеризуют одновременное протекание нескольких процессов – всасывания, распределе- ния и выведения. Выявление наиболее значимых из них является главной задачей при оценке путей превращений ксенобиотиков. Анализ фармакокинетических параметров по- зволяет рассчитывать схемы дозирования лекарств, а также оценивать, прогнозировать и сопоставлять процессы их превращения с точки зрения безопасности применения.
157

а б
Рис. 20. Кинетические кривые лекарственного вещества в крови (а) и их полулогарифмические анамор- фозы (б) при внутривенном введении (1) и приеме внутрь (2)
При приеме лекарства через определенные, равные между собой промежутки времени в крови устанавливаются колебания уровня препарата около среднего значения Сср (рис. 21). Обозначив эффективную концентрацию лекарства в крови Сssmin, а максимально до- пустимую безопасную концентрацию – Сssmax, увидим, что оптимальным будет устано- вившийся уровень в интервале Сssmin < Сср < Сssmax, называемый «коридором безопасно- сти». Таким образом осуществляют терапевтический мониторинг лекарств, служащий ос- новой безопасного лечения.
Рис. 21. Зависимость концентрации лекарственного препарата в крови от времени при повторных приемах дозы (D)
через равные интервалы времени (τ)
Одним из основных подходов биофармацевтических исследований для изучения меха- низма качественных и количественных изменений ЛВ в организме человека является расчет и оценка фармакокинетических параметров. Понятие «фармакокинетика», как известно, оп- ределяет судьбу ЛВ в организме – его всасывание, распределение, метаболизм, выведение. Знание механизма и количественная оценка процессов биотрансформации позволяет прово- дить выбор доз ЛВ, а также правильное комбинирование лекарств и оценку риска возмож- ного возникновения нежелательных побочных эффектов. Кроме того, знание фармакокине- тики ЛС дает возможность обеспечения оптимального интервала терапевтических концен- траций ЛВ в области рецептора.
Весьма важным с точки зрения фармакокинетики является установление фармакоки- нетических параметров тест-препаратов для различных полиморфных форм ферментов окисления и ацетилирования. При введении тест-препаратов возможным является получе- ние зависимостей «концентрация – время» в биологических жидкостях для различных способов введения и расчет системных параметров ЛС. Наиболее важными фармако- кинетическими параметрами являются площадь под фармакокинетической кривой AUC, константа элиминации kel, время полувыведения Т1/2 и объем распределения Vd.
Объем распределения выступает в роли коэффициента пропорциональности между введенной дозой препарата и концентрацией препарата в кровяном русле сразу после им- пульсного введения, измеряемой для данной дозы:
158

Vd = D/C0
Большие значения данного параметра указывают на высокую концентрацию препара- та в крови сразу после его введения. При этом важным выводом является то, что нужный фармакологический эффект может наблюдаться и при меньшей дозе ЛВ, а слишком большое содержание ЛВ в крови может привести к возможной интоксикации.
Величина площади под кинетической кривой концентрация – время пропорциональна концентрации препарата:
∞
AUC = ∫C(t)dt
0
Величина площади под кинетической кривой оказывается весьма полезной при оценке относительной терапевтической эффективности различных ЛФ одного и того же ЛС и отражает количество вещества, поступающего в кровь после его однократного введения, что позволяет рассчитать величину объема распределения препарата, не используя вели-
чину С0:
V d |
= |
D |
|
AUC × kel |
|||
|
|
В линейной фармакокинетике величина AUC пропорциональна количеству ЛВ, дос- тигшего системного кровотока.
Время полуэлиминации (время полувыведения) из организма половины введенной до- зы препарата соответствует времени уменьшения концентрации препарата в крови в два раза. Константа элиминации и время полувыведения являются обратными величинами, следовательно, для испытуемых с невысокими значениями kel характерны более высокие величины времени полувыведения:
T1/ 2 = 0.693
kel
Основной проблемой, которую можно решить фармакокинетическими методами, яв- ляется выбор оптимальных доз ЛС. Проведение фармакокинетических исследований с це- лью расчетов режимов дозирования ЛВ представляет собой актуальную задачу, так как индивидуальная вариабельность фармакокинетических параметров у лиц с разными фено- типами генетически детерминированных систем биотрасформации достаточно высока. Особенно важно обеспечить оптимальный режим введения препаратов, имеющих малый диапазон между терапевтической и токсической дозами. Кроме того, фармакокинетиче- ские подходы значительно надежнее, чем попытки прогноза состояния генетически де- терминированной ферментной системы по какому-либо одному фактору, поскольку по- зволяют учитывать индивидуальные особенности отдельных ферментов и дают о них раз- ностороннюю информацию.
Так, при помощи методов биофармацевтического анализа определяют содержание в биологических жидкостях тест-препарата ацетилирования – гидразида изоникотиновой кислоты (ГИНК, изониазида):
O |
|
C |
|
NH |
|
NH2 |
|
|
|
|
|
|
|
|
|
|
|
O + KoASH |
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
+ CH3 |
C |
|
S |
|
KoA |
NAT |
N |
|
|
|
C |
|
NH |
|
NH |
|
C |
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
|
|
N |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH3 |
|
|
|
|
|
|
|
O |
|
|
|
O |
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||
Такой биофармацевтический анализ позволяет выявлять индивидуальные генетически обусловленные различия процессов ацетилирования у различных людей. При этом ско- рость метаболизма противотуберкулезного препарата изониазида распределяется бимо- дально (рис. 22). Причина этого явления в различной активности у разных людей N– ацетилтрансферазы – фермента, катализирующего реакции конъюгации ариламинов, в том числе изониазида. Людей, у которых ацетилирование протекает медленно, называют «медленными ацетиляторами». У других людей так называемых «быстрых ацетиляторов»
159
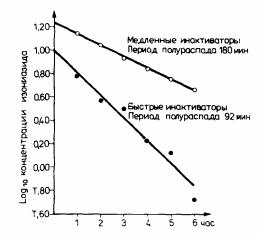
реакция идет в несколько раз быстрее (t1/2 изониазида 60 и 240 мин соответственно). Поз- же было обнаружено, что полиморфизм ацетилирования наблюдается и для ряда других препаратов, молекула которых трансформируется путем присоединения по атому азота ацетильной группы.
Рис. 22. Период полувыведения изониазида у пациентов с быстрой и медленной инактивацией препарата
Соотношение быстрых и медленных ацетиляторов меняется в зависимости от этниче- ских групп (табл. 17). В европеоидной и негроидной популяциях соотношение быстрых и медленных ацетиляторов примерно равное, у египтян преобладают медленные ацетилято- ры (82%), в то время как у эскимосов и японцев медленные ацетиляторы составляют 10– 12%.
Как правило, полиморфизм метаболизма ЛС проявляется как би- или тримодальность. В первом случае говорят о наличии в популяции фенотипов быстрого и медленного мета- болизма (БМ и ММ) ЛВ; во втором – добавляется фенотип промежуточной активности метаболизма.
Таблица 17. Частотность медленных ацетиляторов различных этнических групп
Популяция |
Частотность |
|
«медленного фенотипа», % |
||
|
||
Эскимосы Канады |
0,05 |
|
Эскимосы Южной Аляски |
0,18 |
|
Эскимосы Северной Аляски |
0,27 |
|
Японцы |
0,11 |
|
Корейцы |
0,10 |
|
Китайцы |
0,15 |
|
Индийцы |
0,58 |
|
Негры США |
0,51 |
|
Негры Судана |
0,65 |
|
Амхара (Эфиопия) |
0,83 |
|
Бушмены |
0,30 |
|
Арабы Египта |
0,83 |
|
Белое население США |
0,58 |
|
Немцы |
0,44 |
|
Скандинавы США |
0,67 |
|
Итальянцы США |
0,64 |
|
Финны |
0,64 |
|
Саами |
0,28 |
|
Норвежцы |
0,52 |
|
Русские |
0,52 |
При получении группой лиц стандартной дозы противотуберкулезного препарата изониазида величины, характеризующие уровень этого препарата в крови через 6 часов после введения, и процент введенного ГИНК, экскретируемого с мочой в свободной не-
160
