
11 himpopel p u
.pdf
Мал. 3.
К у л е с т е р ж н е ві моделі молекул
ЧГ 5
Р
Мал. 4.
2з - 0рбіталь і три 2р-орбіталі
СНД С7Нд
Будова молекули метану. Гібридизація орбіталей. Зовнішні електрони в ізольованому атомі Карбону розміщені в 2я- і 2р-орбіталях. Вам відомо, що 8-орбі- таль є сферичною, а р-орбіталі — гантелеподібними, зорієнтованими у трьох взаємно перпендикулярних напрямах уздовж осей х, у, г (мал. 4).
В органічних сполуках атом Карбону чотиривалентний. Необхідною умовою для цього є перехід атома у збуджений стан. Унаслідок переміщення 2з-електрона у вакантну 2р-орбі- таль усі чотири електрони зовнішнього енергетичного рівня стають неспареними:
СС*
...2зг2р2 -> ...2з12р3
" |
2 |
2 |
|
|
р |
|||||
|
т |
т |
|
|
25 |
т |
|
1 |
т |
|
|
|
|
|
|
т |
|
|
|
|
|
основний стан |
збуджений |
стан |
||||||||
Енергія, яка витрачається на такий перехід, компенсується енергією, що виділяється під час утворення атомом Карбону ковалентних зв'язків.
У молекулі метану СН4 атом Карбону сполучений із чотирма атомами Гідрогену. В утворенні зв'язків С - Н беруть участь чотири неспарені електрони збудженого атома Карбону — один 8-електрон і три р-електрони. Ковалентний зв'язок за участю 8-електрона атома Карбону має відрізнятися від зв'язків за участю р-електронів. Проте в результаті досліджень учені з'ясували, що всі зв'язки С -Н у молекулі метану рівноцінні: на руйнування кожного зв'язку витрачається однакова кіль-
28
кість енергії. Це можливо, якщо при утворенні молекули СН4 (з атомів) енергії 8-електрона ір-електронів атома Карбону вирівнюються, а їхні орбіталі набувають однакової форми і розміщуються на максимальній та однаковій віддалі одна від одної.
Процес вирівнювання електронів за енергією, а їхніх орбіталей за формою і розміщенням у просторі називають гібридизацією.
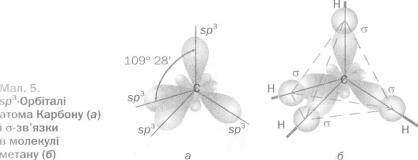
У молекулі метану змінені, або гібридні, орбіталі мають форму об'ємної несиметричної вісімки ( € Х ^ ). Вони зорієнтовані одна щодо
одної під кутами 109° 28', тобто у напрямках від центра тетраедра до його вершин (мал. 5, а). Позначення кожної такої орбіталі — зр3; воно складається з позначень вихідних орбіталей та їх кількості. Цей тип гібридизації називають 8р3-гібридизацією.
У молекулі метану чотири ^ - орбіталі атома Карбону перекриваються із 8-орбіталями атомів Гідрогену (мал. 5, б). Тому молекула метану має форму тетраедра; у його центрі розміщений атом Карбону, а у вершинах — атоми Гідрогену.
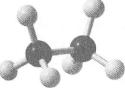
Будова молекул гомологів метану. Ковалентні зв'язки в молекулі етану С2Н6 утворюються за рахунок перекривання зр3-орбіталей двох атомів Карбону одна з одною і з 8-орбіта- лями атомів Гідрогену.
29
Цікаво знати
Структурні
формули
молекул алканів іноді зображають, показуючи лише зв'язки між атомами Карбону:
(пропан).
•Зобразіть у зошиті будову молекули етану (за зразком малюнка 5, б).
Умолекулах інших алканів зв'язки між
атомами Карбону також реалізуються внаслідок перекривання їхніх е/з'1-орбіталей. Тому карбонові ланцюги в них зигзагоподібні, а
кути на всіх ділянках ламаної лінії становлять 109° 28!:
СН? |
СН, СН2 |
|
|
X V |
х |
СН з СН2 СН2 |
СН3 |
|
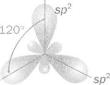
Будова молекули етену. У молекулі IIД' СІ І., кожний атом Карбону сполучається з іншим атомом Карбону і двома атомами Гідрогену. Із його чотирьох орбіталей, у яких перебуває по одному зовнішньому електрону, лише три — 8-орбіталь і дві р-орбіталі — зазнають гібридизації (мал. 6). Три утворені §р2-орбіталі розміщуються під кутами 120°. Одна з них перекривається з такою самою орбіталлю іншого атома Карбону, а дві — із я-орбі талями двох атомів Гідрогену (мал. 7). Між цими атомами утворюються ст-зв'язки.
Мал. 6.
Схема утворення
зр2-орбіталей |
|
зр- |
в атомі Карбону |
|
|
|
Н |
н |
|
ст |
о |
|
|
СУ |
|
С |
С |
Мал. 7. |
,, |
і, |
.-. > |
Н |
н |
Зв язки |
0 |
0 |
в молекулі |
|
|
етену |
|
|
зо |
|
|

Мал. 8.
Схема утворення чр-орбіталей н атомі Карбону
Третя р-орбіталь кожного атома Карбону залишається незмінною. Такі орбіталі розміщені перпендикулярно до гібридних орбіталей і перекриваються на двох ділянках — над і під лінією, яка з'єднує центри атомів Карбону (мал. 7). У результаті між цими атомами утворюється ще й я-зв'язок.
Отже, подвійний зв'язок у молекулі етену складається із а-зв'язку і л-зв'язку:
Центри всіх атомів молекули етену перебувають в одній площині,
У молекулі етену відстань між центрами атомів Карбону менша, ніж у молекулі етану (я-зв'язок наче «стягує» атоми).
•Порівняйте довжину та енергію зв'язків між атомами Карбону в молекулах етану й етену за даними, наведеними в таблиці 1.
Навколо л-зв'язку неможливе обертання груп атомів СН2 (відмінність від а-зв'язку між атомами Карбону в молекулі етану С2Н6). У цьому можна переконатися, використавши кулестержневу модель молекули етену.
Будова молекули етику. У молекулі НС=СН кожний атом Карбону утворює два а-зв'язки. У них беруть участь ,? електрон і р електрон. Орбіталі цих. електронів зазнають гібридизації і перетворюються на дві гібридні зр-орбі- талі, які розміщуються у просторі під кутом 180° (мал. 8). Одна з них перекривається із 8-орбіталлю атома Гідрогену, а друга — з гібридною орбіталлю іншого атома Карбону (мал. 9). Центри всіх атомів молекули С2Н2 розміщені на прямій лінії.
гг>
р
1 8 0°
31

Мал, 9. |
7 |
Зв'язки |
|
в молекулі етану |
|
Інші два р-електрони кожного атома Карбону беруть участь в утворенні двох л-зв'яз- ків. їхні р-орбіталі попарно перекриваються. Ділянки перекривання цих орбіталей перебувають поза лінією, яка з'єднує центри атомів.
Отже, потрійний зв'язок у молекулі етину складається з одного ст-зв'язку і двох тг-зв'язків:
Н - С І С - Н
Із викладеного матеріалу можна зробити такий висновок: тип гібридизації орбіталей атома Карбону визначає просторову будову молекули вуглеводню.
Конформації молекул. Групи атомів у молекулах етану та інших вуглеводнів можуть обертатися навколо простих зв'язків (ст-зв'яз- ків). Такі молекули постійно змінюють свою форму; при цьому кути між напрямами орбіталей і довжини зв'язків залишаються незмінними.
Просторову форму, якої набуває молекула при обертанні будь-якої групи атомів навколо ст-зв'язку, називають конформацією.
ЛАБОРАТОРНИЙ ДОСЛІД № 1 Конформації молекули етану
Виготовте кулестержневу модель молекули етану. Для цього виберіть у наборі для складання моделей молекул кульки, що імітують атоми Гідрогену і Карбону, а також стержні
32
або трубочки. Складаючи модель, візьміть до уваги, що всі кути між лініями, які з'єднують центри атомів Карбону і Гідрогену в молекулі етану, становлять 109° 28'.
Розмістіть модель молекули перед собою так, щоб один атом Карбону закрив собою другий, і повільно обертайте одну групу атомів СН3 навколо простого зв'язку.
Зафіксуйте дві форми молекули етану — з мінімальними і максимальними відстанями між атомами Гідрогену різних груп СН3. Ці форми називають граничними конформаціями. Яка із них, на вашу думку, є найбільш вигідною, тобто відповідає найменшій енергії?
Мал. 10.
Кулестержневі моделі граничних конформацій молекули етану:
а— затінена;
б— загальмована (внизу — вигляд кожної моделі з боку групи атомів СН3 )
Моделі граничних конформацій молекули етану наведено на малюнку 10. У конформації а відстані між атомами Гідрогену різних груп СН3 є найменшими з усіх можливих. Ці атоми зазнають помітного взаємного відштовхування, бо мають однаковий (позитивний) заряд1. У такої конформації найбільша енергія; її називають затіненою (мал. 10, а). Із цього стану молекула намагається перейти у стан із найменшою енергією, тобто в конформацію б. У ній атоми Гідрогену, перебуваючи на максимально можливих відстанях, найменше відштовхуються один від одного.
„
б
А
' Відштовхуються також електронні пари хімічних зв'язків С-Н різних груп СН3.
33

Цю конформацію називають загальмованою (мал. 10, б). У ній молекула етану перебуває найчастіше.
Про конформації молекул циклічних насичених вуглеводнів ітиметься в § 7.
Для пояснення просторової будови молекул використовують уявлення про гібридизацію орбіталей. Гібридизація — процес вирівнювання електронів атома за енергією, а їхніх орбіталей — за формою і розміщенням у просторі.
Розрізняють три типи гібридизації: зря, 8р2, 8р. Форму, якої набуває молекула при обертанні груп атомів навколо простого зв'язку, називають конформацією. Для молекули етану існують дві граничні конформації — загальмована (найстійкіша) і затінена (найменш стійка). У
загальмованій конформації взаємне відштовхування атомів Гідрогену різних груп СН3 є міні-
мальним.
24.Назвіть типи гібридизації орбіталей атома Карбону.
25.Поясніть просторову будову молекули метану.
26.Охарактеризуйте хімічні зв'язки в молекулах: а) метану; б) етену; в) етину.
27.Які електронні орбіталі перекриваються в молекулах метану етану, етену й етину?
28.Знайдіть відповідність.
Ковалентний зв'язок |
Складові зв'язку |
1) простий; |
а) тс-зв'язок; |
2) подвійний; |
б) ст-зв'язок; |
3) потрійний; |
в) ст-зв'язок і два л-зв'язки; |
|
г) два ст-зв'язки і л-зв'язок; |
|
ґ) ст-зв'язок і л-зв'язок. |
34
:>9. Знайдіть відповідність. |
Тип гібридизації |
|
Формула |
НКількість ст-зв'язків |
|
молекули |
у молекулі |
атома Карбону |
1) СН4; |
А) два; |
а) зр; |
2) С2Н4; |
Б) три; |
б) зр2; |
3) С2н2; |
В)чотири; |
в) зр3; |
|
Г) п'ять; |
г) гібридизації |
|
Ґ) шість; |
немає. |
30.Чи можуть групи атомів обертатися в молекулі навколо ковалентних зв'язків? Чи залежить відповідь від того, яким є зв'язок — простим, подвійним, потрійним? Дайте пояснення.
31.Охарактеризуйте конформації молекули етану.
Насичені вуглеводні
Нуглеводні, у молекулах яких атоми Карбону сполуче- н і лише простими ковалентними зв'язками, називають
насиченими.
Насичені вуглеводні поділяють на алкани і циклоалкани.
5 Алкани
Матеріал параграфа допоможе вам:
пригадати склад і будову молекул алканів; отримати відомості про ізомерію алканів; складати структурні формули молекул алканів; називати алкани за правилами систематичної номенклатури.
Склад молекул. Ви знаєте, що найпростішим насиченим вуглеводнем є метан СН4 (мал. 11).
35

Насичені вуглеводні з відкритим карбоновим ланцюгом у молекулах називають алканами\
Алкани
С„Н2 ( 1 + 2
Мал. 11.
Масштабна модель молекули метану
Загальна формула алканів — Сп Н2 „+ 2 (п 1, 2, ...). У молекулах цих вуглеводнів атоми Карбону перебувають у стані 8р3-гібридизації, а кути між лініями, що з'єднують центри сусідніх атомів, становлять 109° 28'.
Вуглеводні СН4, С2Н6, С3Н8 та інші аналогічні сполуки утворюють гомологічний2 ряд алканів. Вам відомо, що гомологічний ряд — це ряд органічних сполук, молекули яких подібні за будовою і різняться на одну або кілька груп атомів СН2 (так звану гомологічну різницю). Гомологічний ряд також називають за сполукою, яка його започатковує. Сполуки С2Н6, С3Н8 та інші є гомологами і належать до гомологічного ряду метану.
Ізомерія. Ізомери існують майже для всіх алканів, крім метану, етану і пропану. Молекули ізомерних алканів різняться послідовністю сполучення атомів Карбону. Ви знаєте, що таку ізомерію називають структурною.
З'ясуємо, скільки існує ізомерів із формулою С4Н10.
ЛАБОРАТОРНИЙ ДОСЛІД № 2 Виготовлення кулестержневих моделей молекул С4Н10
Скориставшись набором для складання моделей молекул, зберіть карбоновий ланцюг, послідовно з'єднавши чотири атоми Карбону під певними кутами.
Чи можливий інший варіант сполучення цих атомів? Якщо можливий, реалізуйте його, взявши нові кульки та стержні (палички).
Приєднайте до кожного атома Карбону відповідну кількість атомів Гідрогену.
' Дуже рідко використовують назву «парафіни».
2 Термін походить від грецького слова Ьото1о£оз — подібний.
36
І Іеревірте на виготовлених моделях молекул, чи можуть різні групи атомів обертатися навколо о-зв'язків.
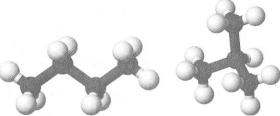
Ви виготовили моделі молекул двох ізомерних алканів С4Н10 — з нерозгалуженим і розгалуженим карбоновими ланцюгами (мал. 12). Структурні формули цих молекул та їх скорочені варіанти мають такий вигляд:
н н н н |
Н Н Н |
|||||
І |
І |
І |
|
І |
І І |
І |
н-с-с-с-с-н |
н-с-с-с-н |
|||||
І |
І |
І |
|
І |
І І |
І |
н |
н |
н |
н |
|
н еі |
\н |
|
|
|
|
|
Н Н |
Н |
сн3-сн2-сн2-сн3 |
сн3-сн-сн3 |
|||||
СН3
Мал. 12.
Кулестержневі
моделі молекул
ізомерних алканів С 4 Н 1 0
Ізомери різняться не тільки за будовою молекул, а й за властивостями. Так, температура кипіння бутану з нерозгалуженими молекулами становить - 0 , 5 °С, а його ізомеру з розгалуженими молекулами - 1 1 , 7 °С. Існують відмінності й у хімічних властивостях ізомерів.
Зі збільшенням кількості атомів Карбону в молекулах алканів кількість ізомерів зростає. Наприклад, відомі два алкани С4Н10, три алкани С5Н12, п'ять алканів С6Н14, дев'ять алканів С7Н16, а кількість ізомерів із формулою С10Н22 сягає 75.
Назви. У XX ст. було розроблено систему назв (номенклатуру) органічних сполук. Згідно з нею назви всіх алканів мають суфікс -ан.
37
