
- •Федеральное агентство по образованию
- •им. М. В. Ломоносова
- •И. А. Туторский
- •5. Адсорбция на границе раствора с газом
- •5.1. Поведение растворенных веществ на границе раствора с газом
- •5.2. Поверхностная активность
- •5.3. Поверхностно – инактивные вещества
- •5.4. Вывод адсорбционного уравнения Гиббса
- •5.5. Строение адсорбционного слоя ПАВ на границе раствора с газом
- •5.6. Уравнение состояния двумерного газа
- •5.7. Диаграммы состояния поверхностных пленок
- •5.8. Химические реакции в поверхностных пленках
- •5.9. Самоорганизованные монослои и пленки, перенесенные на твердую подложку с поверхности вода-воздух (пленки Ленгмюра –Блоджетт)
- •5.10. Двухсторонние пленки
- •5.11. Вид изотермы поверхностного натяжения. Уравнение Шишковского
- •5.12. Связь уравнений Ленгмюра и Гиббса с помощью уравнения Шишковского
- •5.13. Вывод уравнения Ленгмюра при совместном решении уравнений Гиббса и Шишковского
- •5.14. Правило Траубе
- •6. АДСОРБЦИЯ НА ГРАНИЦЕ РАЗДЕЛА ТВЕРДОЕ ТЕЛО – РАСТВОР
- •6.1. Введение
- •6.2. Правило вытеснения
- •6.3. Когезия и адгезия
- •6.4. Смачивание и растекание
- •6.5. Практическое значение смачивания
- •6.6. Правило выравнивания полярностей
- •6.7. Адсорбция полимеров из растворов на твердой поверхности
- •7. Коллоидные ПАВ
- •7.1. Введение
- •7.2. Производство и применение ПАВ
- •7.3. Биоразлагаемость и токсичность
- •Рис. 7.1. Биоразлагаемость анионных ПАВ. 1-тетрапропиленбензолсульфонат натрия, 2-линейный алкилбензолсульфонат, 3-алкилсульфат
- •7.4. Классификация и общая характеристика ПАВ
- •7.5. Свойства водных растворов ПАВ. Мицеллообразование
- •Рис. 7.3. Строение сферической мицеллы ПАВ в воде.
- •7.6. Влияние различных факторов на ККМ
- •7.6.1. Влияние длины углеводородного радикала
- •7.6.2. Влияние строения углеводородного радикала
- •7.6.3. Влияние добавок электролитов
- •7.6.4. Влияние полярных органических веществ
- •7.7. Термодинамика мицеллообразования в водной среде
- •7.8. Зависимость растворимости ПАВ в воде от температуры
- •7.9. Мицеллообразование в неводных средах
- •7.10. Оценка дифильных свойств ПАВ
- •7.11. Солюбилизация
- •7.12. Физико-химия моющего действия
- •7.13. Смеси ионных и неионных ПАВ
- •Содержание
константы уравнения поверхностного натяжения, можно определить константы уравнения Ленгмюра.
5.13. Вывод уравнения Ленгмюра при совместном решении уравнений Гиббса и Шишковского
Совместное решение уравнений Гиббса и Шишковского позволяет перейти от уравнения Гиббса к уравнению Ленгмюра. Преобразуем уравнение Шишковского:
0 0 B ln(CA 1) 0 B d ln(C A) 0 B ln A
После дифференцирования:
d 0 B d ln(C A) 0 B |
dC |
|||||||||||||||||||||||||||
C A |
||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
т. к. d ln X |
dX |
|
, то найдем |
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
X |
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
d |
|
|
0 |
|
B |
|
|
|
|
|
||||||||||
|
|
|
|
|
|
dC |
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
C A |
|
|
|
|
|
||||||||||
подставим значение |
d |
|
в уравнение Гиббса. |
|||||||||||||||||||||||||
dC |
||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
Г |
|
С |
|
|
d |
|
|
|
C |
|
|
|
0 B |
|
|: A |
|||||||||||||
|
|
|
|
|
R T |
|
(C A) |
|||||||||||||||||||||
|
|
|
R T dC |
|
|
|
|
|
|
|
|
|||||||||||||||||
|
|
|
|
|
|
Г |
0 |
|
B |
|
|
|
C A |
|
|
|||||||||||||
|
|
|
|
|
|
R |
T |
|
C |
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
1 |
A |
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
1 |
K ; |
Г Г |
max |
|
|
|
|
|
K C |
|
|
|||||||||||||||||
|
|
A |
|
|
1 K C |
|
|
|||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
т. е. получаем уравнение Ленгмюра, в котором K равновесия процесса адсорбции неактивных веществ.
30
(5.26)
(5.27)
(5.28)
(5.29)
(5.30)
- константа
( 4 ) (рис. 6.7). Сумма относительных количеств центров каждого
типа, равна единице, т.е. 1 2 3 4 1.
Многоцентровый характер адсорбции полимеров из раствора приводит к образованию в пределах одной макромолекулы участков непосредственно контактирующих с поверхностью, (эшелонов), свободных "хвостов" и "петель". Современные теории адсорбции позволяют дать количественную характеристику адсорбированной макромолекулы. Можно вычислить средние длины хвостов, участков, контактирующих с поверхностью, петель и их распределение по размерам. С учетом энтропии образование "хвостов" предпочтительнее образования "петель". Петли обладают меньшей конформационной свободой, чем хвосты такой же длины, что затрудняет приближение "петель" к поверхности. Можно получить также концентрационные профили сегментов петель и хвостов.
Рис. 6.7. Адсорбция макромолекул на твердой поверхности.
При построении теоретической ленгмюровской изотермы адсорбции учитываются только два типа центров: свободные и занятые.
При построении экспериментальной изотермы адсорбции учитываются все четыре типа центров. Это приводит к значительному отличию теоретической и экспериментальной изотерм (рис. 6.8).
55
www.mitht.ru/e-library
макромолекул из раствора на поверхность, происходящий в критической точке, является фазовым переходом II рода, о чем свидетельствуют изломы в энергии и энтропии системы.
Рост термодинамической жесткости цепи (увеличение сегмента)
приводит к убыванию критической энергии 0 , требуемой для начала адсорбции. Это объясняется тем, что энтропийные потери цепи при адсорбции убывают с ростом жесткости, т.е. для их компенсации требуется меньшая энергия связывания с поверхностью.
Вторичная структура макромолекулы влияет на ее адсорбцию, т. к. сорбционная активность спиральных и клубковых звеньев различна. И наоборот, степень спиральности адсорбированных цепей отличается от исходной степени спиральности макромолекул в растворе.
При рассмотрении адсорбции полимеров из разбавленного раствора необходимо принимать во внимание конформацию
макромолекулы, характеризуемую средними размерами цепи (r 2 )1/ 2 и
(h2 )1/ 2 .
Изотермы адсорбции полимеров из раствора отличаются от изотерм Ленгмюра. Иногда изотермы представляют собой кривые с одним или двумя максимумами. Один максимум имеет изотерма адсорбции полиметилметакрилата из толуольного раствора.
При адсорбции макромолекул на твердой поверхности различают четыре типа центров поверхности: занятые ( 1 ) , экранированные макромолекулой ( 2 ) , находящиеся между адсорбированными макромолекулами в количестве, меньшем минимально необходимого для удержания макромолекулы на поверхности ( 3 ) , свободные
54
B |
Гmax R T |
(5.31) |
|
0 |
|||
|
|
Уравнение Шишковского связывает термодинамические представления, на основе которых получено уравнение Гиббса, с молекулярно-кинетическими, на основе которых получено уравнение Ленгмюра.
Это свидетельствует о единстве явления адсорбции, его единой физико-химической природе и о правомерности использования при его рассмотрении подходов (методов) физической химии: термодинамического, дающего общую картину явления и молекулярно-кинетического, позволяющего представить конкретный механизм этого явления.
5.14. Правило Траубе
Экспериментально установлено, что Гmax |
const для всех его |
||||
членов данного гомологического ряда ПАВ. |
Гmax f (n) , где n - |
||||
число групп |
CH 2 |
в соединении. Это означает, |
что адсорбционный |
||
слой ПАВ |
при |
Гmax |
мономолекулярен, |
и |
неполярные части |
ориентированы вертикально (частокол Ленгмюра).
определяет площадь поперечного сечения молекулы,
следовательно, и B определяет площадь поперечного сечения молекулы и мало зависит от природы ПАВ. Из уравнения Шишковского следует, что при малых значениях C :
|
d |
0 B |
1 |
(5.32) |
|
dC |
A |
||||
|
|
|
31
www.mitht.ru/e-library

Оказалось, что поверхностная активность ddC в гомологическом
ряду ПАВ изменяется в геометрической прогрессии при увеличении длины цепи в арифметической. Правило Траубе гласит, что в
гомологическом ряду алифатических соединений при увеличении
длины цепи на одну группу CH 2 поверхностная активность увеличивается в 3,2 раза. Правило Траубе относится только к границе водный раствор – воздух. Его можно записать в виде:
d |
d |
3,2 |
|
||||
|
|
|
|
|
|
(5.33) |
|
|
|
||||||
dC n 1 |
dC n |
|
|
||||
Согласно уравнению (5.32) 0 B постоянно для всех членов ряда
- ddC ~ 1A ~ К.
Следовательно,
Kn 1 |
3,2 |
(5.34) |
|
Kn |
|||
|
|
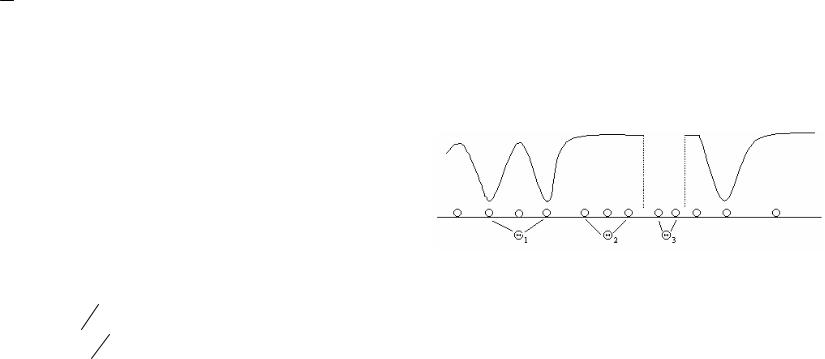
На рис. 5.17 показано влияние низших членов гомологического ряда низших алифатических спиртов на поверхностное натяжение воды. Чем длиннее углеводородная цепь, тем меньше растворимость спирта в воде, тем больше способность молекулы спирта адсорбироваться на поверхности раздела воды с воздухом и снижать поверхностное натяжение.
32
микрогетерогенных систем (наполненные полимеры, блоксополимеры, аморфно-кристаллические полимеры). Эффекты адсорбции макромолекул определяют адгезию полимеров к различным субстратам, проявляются при взаимодействии биополимеров с поверхностями клеток. Нативная структура биополимеров образуется в результате адсорбции макромолекулы на самой себе (белковая глобула) или на комплементарной цепи (двойная спираль ДНК).
Особенностью адсорбции в полимерных системах является существование фазовых переходов различного рода. Важнейшим отличием адсорбции полимеров от адсорбции низкомолекулярных соединений является наличие порогового эффекта. Если значение энергии притяжения звена цепи к поверхности меньше критической
энергии ( 0 ) , требуемой для начала адсорбции |
( ) |
0 |
полимерные клубки остаются в растворе, доля связанного полимера m мала и не зависит от . При больших энергиях притяжения 0 ,
все полимерные цепи связаны с поверхностью, доля свободных молекул в растворе (I - m ) - уменьшается до нуля с ростом . С
увеличением молекулярной массы при N связывание молекул осуществляется скачкообразно: m 0 в докритической области и m 1 непосредственно при переходе через критическую точку 0 .
При этом изменяется конформация цепей. В докритической области макромолекула представляет собой невозмущенный гауссов клубок. После адсорбции, при слабом покрытии поверхности, макромолекулы теряют свойства гауссовых клубков в направлении, перпендикулярном поверхности адсорбента и представляют собой последовательность адсорбированных участков и соединяющих их петель, средние
размеры которых определяются величиной энергии сорбции. Переход
53
www.mitht.ru/e-library

Рис. 6.6. Ориентация молекул ПАВ на границе твердое тело – раствор, а -
неполярный адсорбент из полярной среды, б - полярный адсорбент из неполярной среды.
Неполярная поверхность угля, обращенная к воде, становится более полярной, разность полярностей уменьшается, поверхностное натяжение и свободная энергия на межфазной границе уменьшаются в самопроизвольном процессе адсорбции и ориентации. При адсорбции из неводного раствора на полярном адсорбенте разность полярностей фаз уменьшается вследствие обратной ориентации молекул ПАВ, обращенных полярными группами к полярному адсорбенту (рис. б). При этом процесс протекает также самопроизвольно вследствие уменьшения свободной энергии на поверхности раздела фаз.
Правило Ребиндера выполняется только для физической адсорбции и не выполняется для хемосорбции.
Рис. 5.17. Влияние спиртов на поверхностное натяжение воды.
Траубе установил, что для отдельных гомологических рядов ПАВ концентрация, необходимая для одинакового снижения поверхностного натяжения в разбавленном растворе, уменьшается в
3,2 раза на каждую дополнительную группу CH 2 . Рассмотрим причины этого.
Правило Траубе связано с работой адсорбции. Работа адсорбции, т.е. работа переноса одного моля вещества с поверхности в объем затрачивается на перенос углеводородного радикала. Для переноса функциональной группы не надо совершать работу, т.к. она не выходит из водного окружения. Работа адсорбции A R T ln K . Разность работ адсорбции двух членов гомологического ряда равна:
6.7. Адсорбция полимеров из растворов на твердой поверхности
Взаимодействие макромолекулы с твердой поверхностью лежит в основе многих физико-химических процессов и явлений: гельхроматографии полимеров, стабилизации коллоидов полимерами. Испытываемые молекулами внешние пространственные ограничения определяют структуру цепей в аморфных прослойках
52
An 1 An R T ln Kn 1 R T ln Kn
R T |
ln |
Kn 1 |
|
2 300 2,3 0,5 690 кал/ моль; |
||||
Kn |
||||||||
|
|
|
|
|
|
|||
|
|
|
|
|
Kn 1 |
3,2 |
||
|
|
|
|
|
Kn |
|||
|
|
|
|
|
|
|
||
При переходе |
каждой |
группы |
CH 2 |
из водного окружения на |
||||
границу с воздухом выделяется энергия, |
равная 690 кал/ моль. При |
|||||||
|
|
|
|
|
|
|
33 |
|
www.mitht.ru/e-library
