
- •Федеральное агентство по образованию
- •им. М. В. Ломоносова
- •И. А. Туторский
- •5. Адсорбция на границе раствора с газом
- •5.1. Поведение растворенных веществ на границе раствора с газом
- •5.2. Поверхностная активность
- •5.3. Поверхностно – инактивные вещества
- •5.4. Вывод адсорбционного уравнения Гиббса
- •5.5. Строение адсорбционного слоя ПАВ на границе раствора с газом
- •5.6. Уравнение состояния двумерного газа
- •5.7. Диаграммы состояния поверхностных пленок
- •5.8. Химические реакции в поверхностных пленках
- •5.9. Самоорганизованные монослои и пленки, перенесенные на твердую подложку с поверхности вода-воздух (пленки Ленгмюра –Блоджетт)
- •5.10. Двухсторонние пленки
- •5.11. Вид изотермы поверхностного натяжения. Уравнение Шишковского
- •5.12. Связь уравнений Ленгмюра и Гиббса с помощью уравнения Шишковского
- •5.13. Вывод уравнения Ленгмюра при совместном решении уравнений Гиббса и Шишковского
- •5.14. Правило Траубе
- •6. АДСОРБЦИЯ НА ГРАНИЦЕ РАЗДЕЛА ТВЕРДОЕ ТЕЛО – РАСТВОР
- •6.1. Введение
- •6.2. Правило вытеснения
- •6.3. Когезия и адгезия
- •6.4. Смачивание и растекание
- •6.5. Практическое значение смачивания
- •6.6. Правило выравнивания полярностей
- •6.7. Адсорбция полимеров из растворов на твердой поверхности
- •7. Коллоидные ПАВ
- •7.1. Введение
- •7.2. Производство и применение ПАВ
- •7.3. Биоразлагаемость и токсичность
- •Рис. 7.1. Биоразлагаемость анионных ПАВ. 1-тетрапропиленбензолсульфонат натрия, 2-линейный алкилбензолсульфонат, 3-алкилсульфат
- •7.4. Классификация и общая характеристика ПАВ
- •7.5. Свойства водных растворов ПАВ. Мицеллообразование
- •Рис. 7.3. Строение сферической мицеллы ПАВ в воде.
- •7.6. Влияние различных факторов на ККМ
- •7.6.1. Влияние длины углеводородного радикала
- •7.6.2. Влияние строения углеводородного радикала
- •7.6.3. Влияние добавок электролитов
- •7.6.4. Влияние полярных органических веществ
- •7.7. Термодинамика мицеллообразования в водной среде
- •7.8. Зависимость растворимости ПАВ в воде от температуры
- •7.9. Мицеллообразование в неводных средах
- •7.10. Оценка дифильных свойств ПАВ
- •7.11. Солюбилизация
- •7.12. Физико-химия моющего действия
- •7.13. Смеси ионных и неионных ПАВ
- •Содержание
высокой концентрации ПАВ и больших значениях относительной солюбилизации, когда размер мицелл становится значительным.
7.12. Физико-химия моющего действия
Солюбилизация является одним из основных факторов моющего действия. Другими факторами моющего действия являются
гидрофилизация поверхности, смачивание, в том числе избирательное дипергирование загрязнений, достигаемое механическим воздействием на объект, стабилизация отмытых примесей, предотвращающая ресорбцию, мицеллообразование, т. к.
растворимость ПАВ низка, ПАВ расходуется в моющем процессе, и необходимо поддерживать концентрацию молекулярно-растворенного ПАВ из мицелл, выполняющих функцию «депо» ПАВ.
Процесс моющего действия является сложным физико-химическим процессом разделения многокомпонентных смесей. Он включает несколько взаимосвязанных стадий. При очистке поверхностей от загрязнений должно происходить смачивание обрабатываемой поверхности. ПАВ адсорбируются на поверхности, подлежащей очистке, а также на поверхности воды, уменьшая ее поверхностное натяжение и улучшая смачивание. Промасленный комбинезон не смачивается водой без мыла, но хорошо смачивается раствором ПАВ, т. к. последнее адсорбируется на поверхности масла. Перья водоплавающих птиц не смачиваются водой т.к. смазаны жиром, но хорошо смачиваются любыми маслами, например нефтью.
Вторым фактором моющего действия является диспергирование загрязнений. Эта стадия осуществляется механическим воздействием на отмываемую поверхность при активирующем действии ПАВ. Необходимо оторвать частицы грязи от поверхности и перевести их в состояние суспензии или эмульсии. Нельзя допустить повторного
78
Способность молекул ПАВ упаковываться в межфазном слое приводит к его растяжению, тогда как силы поверхностного натяжения приводят к сжатию поверхностного слоя. Если растягивающее (или поверхностное) давление адсорбированного слоя ПАВ обозначить через , то поверхностное или межфазное натяжение будет меньше исходного 0 . Если межфазное натяжение между двумя жидкостями уменьшается до достаточно низкого значения при добавлении ПАВ, то легко протекает эмульгирование, так как это требует относительно малого увеличения свободной поверхностной энергии системы. Если 0 , то жидкости либо смешиваются, либо происходит самопроизвольное эмульгирование.
5.3. Поверхностно – инактивные вещества
Поверхностно – инактивные вещества являются антиподами ПАВ.
Молекулы ПИАВ более полярны, чем молекулы растворителя 2 1 .
Для них силы притяжения молекул растворенного вещества и растворителя больше, чем силы притяжения молекул растворителя между собой, т.е. взаимодействие типа 1 1 1 2 , и молекулам растворенного вещества выгоднее находиться в окружении молекул растворителя. Вследствии этого молекулы растворенного вещества стремятся мигрировать с поверхности в объем, для системы это термодинамически выгодно. Поэтому ПИАВ характеризуются отрицательной адсорбцией, недостатком вещества на поверхности,
для них Г 0 . ПИАВ обладают высокой растворимостью и значением поверхностного натяжения большим, чем у растворителя,
ПИАВ Растворителя .
7
www.mitht.ru/e-library
Вследствие высокой растворимости, сродства к растворителю, поверхностно-инактивное вещество хорошо взаимодействует с растворителем и находится в объеме, а не на поверхности. Поверхностное натяжение раствора становится больше, чем чистого растворителя 0 , так как взаимодействие между молекулами ПИАВ и растворителя больше, чем между молекулами растворителя.
Поэтому ddC 0 .
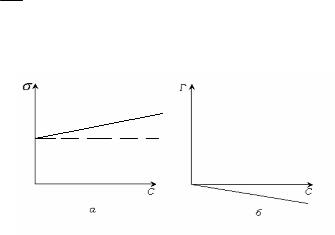
Вид изотермы поверхностного натяжения и адсорбции растворов, содержащих ПИАВ, показан на рис. 5.3 .
Рис. 5.3. Изотермы поверхностного натяжения (а) и адсорбции (б) растворов ПИАВ.
Наклон изотерм не большой, так как повышение свободной
поверхностной энергии F S невыгодно. Вследствие теплового движения молекулы ПИАВ находятся и в поверхностном слое.
Некоторое увеличение поверхностного натяжения, а значит и F S перекрывается ростом энтропии системы за счет распределения вещества. Если бы в поверхностном слое не было бы молекул адсорбата, энтропия системы была бы меньше.
К ПИАВ относятся неорганические электролиты, образующие
гидратированные ионы, кислоты, щелочи, соли, а также хорошо
8
ультрадисперсные частицы (наночастицы) путем проведения реакции в мицеллах ПАВ, содержащих солюбилизирующий исходный реагент. Эти ультрадисперсные частицы позволяют получать принципиально новые катализаторы, полупроводники, магнитные частицы, наполнители полимеров. Так, ультрадисперсные полупроводники применяются для фотосенсибилизированного восстановления воды до водорода в присутствии донора электронов. Это является крупным шагом на пути к солнечно-водородной энергетике и к пониманию механизмов фотосинтеза.
Солюбилизация имеет большое значение для повышения полноты извлечения нефти из пластов с помощью мицеллярных растворов.
Явление солюбилизации используется при изготовлении эмульсионных смазочных и охлаждающих жидкостей, фармацевтических препаратов, косметических средств.
Существенное значение солюбилизация имеет в живых организмах – в процессах миграции и усвоения различных олефильных веществ, например жиров, лекарственных средств, при взаимодействии белков с липидами.
Натриевые соли желчных кислот: холановой и дезоксихолевой обладают очень высокой солибилизирующей способностью. Благодаря этому они способствуют первой стадии усвоения жиров в организме. Эти соли солюбилизируют или эмульгируют жиры, вследствие чего происходит их всасывание и переваривание в кишечнике.
Фрагментирование клеточных мембран коллоидными ПАВ объясняется солюбилизацией липидов. В результате солюбилизации образуются термодинамически устойчивые дисперсные системы, называемые микроэмульсиями. Микроэмульсии образуются при
77
www.mitht.ru/e-library
Увеличение олеофильности мицелл и усиление гидрофобных взаимодействий способствует солюбилизации. Поэтому увеличение длины углеводородного радикала улучшает солюбилизацию, а введение в углеводородный радикал ароматических циклов, кратных связей или гетероатомов уменьшает её.
Солюбилизация увеличивается при уменьшении олеофильности солюбилизата. В мицеллярных растворах жирных кислот количество растворенного углеводорода уменьшается в ряду: бензол > толуол > этилбензол > н.гептан > изооктан > н.октан. Это связано с уменьшением растворимости углеводорода в водной фазе. Хотя мицеллярная растворимость увеличивается, общая растворимость уменьшается.
Солюбилизирующаяя способность – одно из практических свойств, определяющих применение коллоидных ПАВ в народном хозяйстве и в быту.
Важную роль явление солюбилизации играет при синтезе каучуков и латексов эмульсионным способом. Все основные стадии процесса полимеризации (инициирование, рост, обрыв цепи) осуществляются в мицеллах коллоидного ПАВ, содержащего солюбилизированный мономер.
Впоследнее время всё большее внимание привлекает
мицеллярный катализ – ускорение или замедление реакции в результате солюбилизации реагентов (или одного из них)
мицеллами коллоидного ПАВ. Возрастание константы скорости реакции при протекании её в мицеллах может достигать 1 ÷ 2 десятичных порядков по сравнению со скоростью реакции в воде.
Внастоящее время развились новые области химии, которые основаны на использовании организованных форм синтетических ПАВ для создания мембраноподобных систем, позволяющих синтезировать
76
ионизирующиеся органические кислоты, у которых органическая часть отсутствует или мала, например, муравьиная, аминоуксусная кислоты. Так как ионы электролита гидратированы, они не могут подходить к поверхности ближе, чем на толщину гидратной оболочки. Выход иона непосредственно в поверхностный слой термодинамически невыгоден вследствие затраты энергии на гидратацию иона.
Третью группу веществ составляют поверхностно-неактивные вещества. По полярности они близки к растворителю. Для них взаимодействие молекул вещества с молекулами растворителя и взаимодействие молекул растворителя между собой одинаковы, т.е.
взаимодействие типа 1 1 2 1. Поэтому вещество равномерно распределяется в объеме и на поверхности и адсорбция равна нулю,
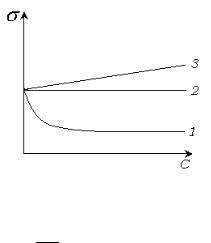
Г 0 . Значения поверхностного натяжения раствора и чистого растворителя равны, 0 . К поверхностно-неактивным веществам относятся сахара. Изотермы поверхностного натяжения ПАВ, ПИАВ и поверхностно-неактивных веществ показаны на рис. 5.4.
Рис. 5.4 Изотермы поверхностного натяжения.
1 - ПАВ. Г 0 ; ddC 0 .
9
www.mitht.ru/e-library

2 - неактивные вещества Г 0 ; ddC 0 .
3 - ПИАВ. Г 0 ; ddC 0 .
После качественного рассмотрения связи адсорбции с поверхностным натяжением перейдем к количественному.
5.4. Вывод адсорбционного уравнения Гиббса
Запишем фундаментальное уравнение Гиббса для поверхностного слоя.
dF S ds S S dT i dNiS |
(5.1) |
Введем полную (внутреннюю) энергию поверхностного слоя.
F S U S T S S ; dF S dU S T dS S S S dT (5.2)
Приравниваем правые части уравнений (4.1) и (4.2) |
|
ds i dNiS dU S T dS S |
|
dU S ds T dS i dNiS |
(5.3) |
Это уравнение однородно и первой степени относительно экстенсивных величин, стоящих под знаком дифференциала.
По теореме Эйлера его можно интегрировать. После интегрирования это уравнение принимает вид:
U S s T S i NiS c |
(5.4) |
Постоянная интегрирования равна нулю с = 0.
Рассмотрим любые возможные изменения системы, т.е. возьмем полный дифференциал от выражения (5.4).
dU S ds S d T dS S S S dT i dNiS NiS d i
(5.5)
10
Система ГЛБ облегчает рациональный выбор ПАВ для решения той или иной задачи: подбора эмульгатора для образования прямой или обратной эмульсии, пенообразователя, солюбилизатора.
7.11. Солюбилизация
Солюбилизацией называется захват ядром мицеллы третьего компонента мицеллярного раствора. Прямые мицеллы солюбилизируют углеводороды, обратные мицеллы – воду и полярные вещества.
Солюбилизация олефильных веществ приводит к более или менее глубокой перестройке мицеллярной структуры раствора. При солюбилизации повышается мицеллярная масса и размер мицелл.
Процесс солюбилизации, также как и мицеллообразование является энтропийным по своей природе, т. е. его движущая сила – положительное изменение энтропии. Это находит изменение с позиций о гидрофобных взаимодействиях в воде. Как уже отмечалось, молекулы углеводородов в водной среде промотируют структурообразование растворителя – возникновение дополнительных водородных связей между молекулами воды, в результате чего вокруг неполярных молекул возникает «льдоподобная» оболочка из структурированной воды. Это приводит к уменьшению энтальпии и значительной убыли энтропии. Внутримицеллярное растворение углеводорода сопряжено с разрушением таких «айcберговых» структур и сопровождается поглощением тепла (∆Н+), однако возрастание энтропии, обусловленное уменьшением степени структурированности воды, компенсирует энтальпийный фактор и обеспечивает убыль свободной энергии (∆Fs>0),что делает процесс термодинамически выгодным.
75
www.mitht.ru/e-library
фиксируют обращение эмульсии и рассчитывают ГЛБ, считая это свойство аддитивным, по формуле:
ГЛБСМ |
WA ГЛБA WB ГЛБB |
|
(7.3) |
|
WA WB |
||||
|
|
|||
где ГЛБСМ – число ГЛБ смеси ПАВ, обеспечивающее получение |
||||
устойчивой эмульсии стандартного масла, WA |
- количество |
|||
эмульгатора А с известным ГЛБ, WB - количество эмульгатора с неизвестным ГЛБ. Для оксиэтилированных продуктов применяется формула Гриффина:
ГЛБ (СЭТ ССП ) / 5 |
(7.4) |
где CЭТ и ССП – соответствующее содержание этиленоксида и спирта, % масс.
Число ГЛБ для данного ПАВ можно рассчитать по аддитивной формуле, зная числа ГЛБ для каждой структурной единицы. Так для гидрофильных групп число ГЛБ положительно и имеет следующие значения: -СООК – 21; -СООН - 2,4; -ОН - 1,9; для гидрофобных групп - СН- , -СН2- , -СН3 - число ГЛБ отрицательно и равно –0,475.
ГЛБПАВ 7 (ГЛБ) Г (ГЛБ) Л (Метод Девиса)
При низком значении числа ГЛБ (1÷4) ПАВ не растворяются и не диспергируются в воде. При значении числа ГЛБ от 8 до 10 они образуют в воде стабильные дисперсии типа молока, а выше 13 - образуют прозрачные растворы.
В зависимости от числа ГЛБ изменяется функциональное назначение ПАВ, чем определяются следующие их области применения: эмульгаторы в/м - 3÷6, смачиватели - 7÷9, моющие вещества - 13÷15.
74
Термодинамические функции не зависят от пути процесса, dUs – полный дифференциал.
Уравнение (5.3) и (5.5) совместимы при условии:
s d S S dT NiS d i 0 |
(5.6) |
Это общий вид адсорбционного уравнения Гиббса. |
Введем |
некоторые ограничения. При T const уравнение Гиббса принимает вид:
|
|
|
s d NiS d i |
0 |: s , |
|
|
Все экстенсивные параметры поверхности (U , S , |
N ) зависят от |
|||||
площади поверхности |
s и, поэтому их удобно относить к единице |
|||||
площади. |
|
|
|
|
|
|
|
|
|
d Гi d i |
0 |
(5.7) |
|
т. к. Гi |
N S |
|
|
|
|
|
i |
– |
мера избыточного |
содержания |
компонента в |
||
s |
||||||
|
|
|
|
|
||
поверхностном слое, мера адсорбции, т. е. величина гиббсовой адсорбции.
d Гi d i |
(5.8) |
|
Для бинарной системы: |
|
|
d Г1 d 1 |
Г2 d 2 |
(5.9) |
где индекс 1 относится к растворителю, 2 – к растворенному |
||
веществу. Изменение связано с |
адсорбцией и с |
изменением |
концентрации растворителя и растворенного вещества. Это уравнение содержит два неизвестных, Г1 , Г2 и поэтому однозначное его решение отсутствует. Один из путей его решения следующий. Величины адсорбции зависят от положения разделяющей поверхности. В зависимости от выбора положения разделяющей
11
www.mitht.ru/e-library
поверхности адсорбция первого компонента оказывается положительной, отрицательной или равной нулю. Гиббс показал, что разделяющую поверхность можно провести так чтобы NiS 0 и
Гi 0 . При таком выборе разделяющей поверхности можно считать,
что адсорбция растворителя отсутствует d Г d .
Перейдем к концентрации.
R T ln a R T ln C , где C – равновесная концентрация в
объеме. |
|
|
|
|
|
||
d R T d ln C ; d Г R T |
dC |
; Г |
С |
|
d |
; |
|
C |
R T |
dC |
|||||
|
|
|
|
||||
Это одно из наиболее важных уравнений коллоидной химии. Оно связывает величину адсорбции с поверхностным натяжением.
Уравнение Гиббса подтверждено экспериментально методом среза тонких слоев и их анализа.
Из этого уравнения видно, что для ПАВ величина адсорбции растет с увеличением концентрации и понижением температуры.
d |
|
|
|
|
|
|
|||
Величину |
|
|
называют |
поверхностной |
активностью |
и |
|||
|
|||||||||
dC C 0 |
|
|
|
|
|
|
|||
обозначают |
символом g в |
честь Гиббса. |
Единицей |
измерения |
|||||
поверхностной активности служит 1 Гиббс. |
|
|
|
|
|||||
Проведем анализ уравнения Гиббса. Если |
d |
0 , то |
Г 0 , |
что |
|||||
dC |
|||||||||
|
|
|
|
|
|
|
|
||
характерно для ПИАВ, проявляющих отрицательную адсорбцию.
12
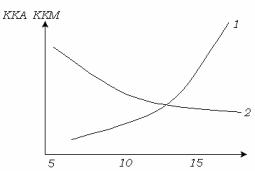
Рис. 7.7 Зависимость ККА (1) и ККМ (2) карбоновых кислот в CCI4 от числа атомов углерода в молекуле.
7.10. Оценка дифильных свойств ПАВ
Оценка дифильных свойств ПАВ проводится разными способами. Одной из характеристик дифильных свойств коллоидных ПАВ является гидрофильно-липофильный баланс (ГЛБ), характеризующий соотношение масс гидрофильной полярной группы и липофильного углеводородного радикала. Система ГЛБ предложена Гриффином в 1949 г. Она является эмпирической. Число ГЛБ определяют путём сравнения способности различных ПАВ к стабилизации эмульсий. Для олеиновой кислоты число ГЛБ условно выбрано равным 1, для олеата натрия оно равно 18. Чем выше гидрофильность, тем выше число ГЛБ, которое изменяется от 1 до 40.
Девис установил количественную связь ГЛБ от состава и структуры ПАВ. Каждая структурная единица вносит свой вклад в числа ГЛБ. Определение чисел ГЛБ проводят следующим образом. Готовят эмульсии из воды и стандартного масла с эмульгатором из смесей ПАВ с известным и неизвестным значением ГЛБ. Эмульсии выдерживают 24 часа, затем определяют наиболее устойчивую или
73
www.mitht.ru/e-library

энтропийную, а энергетическую природу. Она заключается в выгодности замены связи полярная группа – углеводород при молекулярном растворении на связь между полярными группами при их объединении в ядро мицеллы. Энергетический выигрыш системы при объединении полярных групп настолько велик, что при самых малых концентрациях истинных растворов ПАВ находится не в виде отдельных молекул, а в виде предмицеллярных ассоциатов.
В неводных растворах следует различать два уровня ассоциации: первичную ассоциацию, связанную с образованием ди - и тетраметров и мицеллообразование, то есть образование частиц микрофазы. Помимо ККМ, такие системы характеризуются ещё другим параметром, называемым критической концентрацией ассоциации
(ККА). Следует отметить, что в ряду жирных кислот влияние длины углеводородного радикала на ККА и ККМ неоднозначно. С увеличением длины углеводородного радикала значения ККА увеличиваются, а значения ККМ – уменьшаются (рис. 7.7) .
Это объясняется лиофобным взаимодействием углеводородных радикалов в мицелле, тогда как в ассоциате радикалы преимущественно взаимодействуют с растворителем. Это взаимодействие затрудняет образование димеров, а взаимодействие радикалов во внешней части мицеллы между собой облегчает образование мицелл.
72
Если |
d |
0 , |
то Г 0 , что характерно |
для ПАВ, |
|
dC |
|||||
|
|
|
|
проявляющих положительную адсорбцию. Если ddC 0 , то Г 0 ,
что характерно для неактивных веществ.
Используя уравнение Гиббса, можно найти величину адсорбции Г для любого значения С, из тангенса угла наклона касательной к экспериментальной кривой С . Таким путем можно перейти от изотермы поверхностного натяжения к изотерме адсорбции (рис.5.5).
Рис. 5.5. Переход от изотермы поверхностного натяжения к изотерме адсорбции.
tg |
|
Z |
|
|
d |
|
(5.10) |
||
C |
|
dC |
|||||||
|
|
|
|
|
|
||||
|
|
1 |
|
|
|
|
|
||
Г1 |
C1 |
|
|
Z |
|
Z |
(5.11) |
||
R T |
|
|
R T |
||||||
|
|
|
C1 |
|
|||||
Решив уравнение Гиббса для ряда точек, строят изотерму адсорбции.
13
www.mitht.ru/e-library
