
- •Федеральное агентство по образованию
- •им. М. В. Ломоносова
- •И. А. Туторский
- •5. Адсорбция на границе раствора с газом
- •5.1. Поведение растворенных веществ на границе раствора с газом
- •5.2. Поверхностная активность
- •5.3. Поверхностно – инактивные вещества
- •5.4. Вывод адсорбционного уравнения Гиббса
- •5.5. Строение адсорбционного слоя ПАВ на границе раствора с газом
- •5.6. Уравнение состояния двумерного газа
- •5.7. Диаграммы состояния поверхностных пленок
- •5.8. Химические реакции в поверхностных пленках
- •5.9. Самоорганизованные монослои и пленки, перенесенные на твердую подложку с поверхности вода-воздух (пленки Ленгмюра –Блоджетт)
- •5.10. Двухсторонние пленки
- •5.11. Вид изотермы поверхностного натяжения. Уравнение Шишковского
- •5.12. Связь уравнений Ленгмюра и Гиббса с помощью уравнения Шишковского
- •5.13. Вывод уравнения Ленгмюра при совместном решении уравнений Гиббса и Шишковского
- •5.14. Правило Траубе
- •6. АДСОРБЦИЯ НА ГРАНИЦЕ РАЗДЕЛА ТВЕРДОЕ ТЕЛО – РАСТВОР
- •6.1. Введение
- •6.2. Правило вытеснения
- •6.3. Когезия и адгезия
- •6.4. Смачивание и растекание
- •6.5. Практическое значение смачивания
- •6.6. Правило выравнивания полярностей
- •6.7. Адсорбция полимеров из растворов на твердой поверхности
- •7. Коллоидные ПАВ
- •7.1. Введение
- •7.2. Производство и применение ПАВ
- •7.3. Биоразлагаемость и токсичность
- •Рис. 7.1. Биоразлагаемость анионных ПАВ. 1-тетрапропиленбензолсульфонат натрия, 2-линейный алкилбензолсульфонат, 3-алкилсульфат
- •7.4. Классификация и общая характеристика ПАВ
- •7.5. Свойства водных растворов ПАВ. Мицеллообразование
- •Рис. 7.3. Строение сферической мицеллы ПАВ в воде.
- •7.6. Влияние различных факторов на ККМ
- •7.6.1. Влияние длины углеводородного радикала
- •7.6.2. Влияние строения углеводородного радикала
- •7.6.3. Влияние добавок электролитов
- •7.6.4. Влияние полярных органических веществ
- •7.7. Термодинамика мицеллообразования в водной среде
- •7.8. Зависимость растворимости ПАВ в воде от температуры
- •7.9. Мицеллообразование в неводных средах
- •7.10. Оценка дифильных свойств ПАВ
- •7.11. Солюбилизация
- •7.12. Физико-химия моющего действия
- •7.13. Смеси ионных и неионных ПАВ
- •Содержание
5.5. Строение адсорбционного слоя ПАВ на границе раствора с газом
Мы рассмотрели основные закономерности адсорбции ПАВ на границе раствора с газом с термодинамической точки зрения. Рассмотрим теперь ориентацию молекул ПАВ на поверхности и строение адсорбционного слоя.
Пленки ПАВ, образующиеся на поверхности воды, могут находиться в трех агрегатных состояниях: твердом, жидком, газообразном. Агрегатное состояние пленки определяется силами межмолекулярного взаимодействия и площадью, занимаемой молекулой на поверхности. Выталкивание молекул ПАВ на поверхность и их упаковка в адсорбционном слое приводят к растяжению адсорбционного слоя и к существованию поверхностного давления . Силы поверхностного натяжения, наоборот, сжимают поверхностный слой.
Если между молекулами действуют слабые силы, а поверхность велика, то молекулы на поверхности вследствие теплового движения находятся в состоянии двумерного газа. Газообразные пленки образуют дифильные органические вещества с определенной длиной углеводородного радикала, например, жирные кислоты с числом атомов углерода от 11 до 14.
В зависимости от длины углеводородного радикала ПАВ и площади, занимаемой молекулой, монослои ПАВ обладают полиморфизмом, т.е. способны к фазовым переходам. Сжатие монослоя обеспечивается плавучим барьером, на который действует определенная сила. При отсутствии действия силы на подвижный барьер монослой находится в газообразном состоянии (рис. 5.6, а) .
14
Растворы неионогенных ПАВ обладают специфической способностью существенно изменять свои физико-химические свойства при нагревании. Это связано с изменением их растворимости. Растворимость ПАВ уменьшается с повышением температуры. Растворы неионогенных ПАВ имеют нижнюю критическую температуру расслаивания. Для них характерна точка помутнения. Растворимость оксиэтилированных ПАВ в воде обусловлена образованием гидратов вследствие возникновения водородных связей между молекулами воды и эфирными кислородными атомами полиэтиленгликолевого остатка. При нагревании эти связи ослабевают, происходит дегидратация молекул ПАВ, то есть уменьшение растворимости молекул ПАВ, что приводит к агрегации молекул и к появлению опалесценции, а затем и к помутнению раствора.
При дальнейшем нагревании этого раствора происходит укрупнение частиц вплоть до выделения капелек ПАВ в виде отдельной фазы, то есть их “высаливание”. Температура помутнения
раствора (TП ) и температура высаливания раствора (TВ ) ПАВ часто используются в качестве характеристики степени полиоксиэтилирования промышленных продуктов и влияния различных добавок на их растворимость .
7.9.Мицеллообразование в неводных средах
Вневодных средах образуются мицеллы с противоположной ориентацией молекул (обратные мицеллы). Степень ассоциации в обратных мицеллах значительно ниже, чем в прямых, и в отсутствие добавок числа агрегации обычно лежат в интервале 3÷40.
Структура растворителя в присутствии ПАВ существенно не нарушается. Мицеллообразование в неполярных средах имеет не
71
www.mitht.ru/e-library
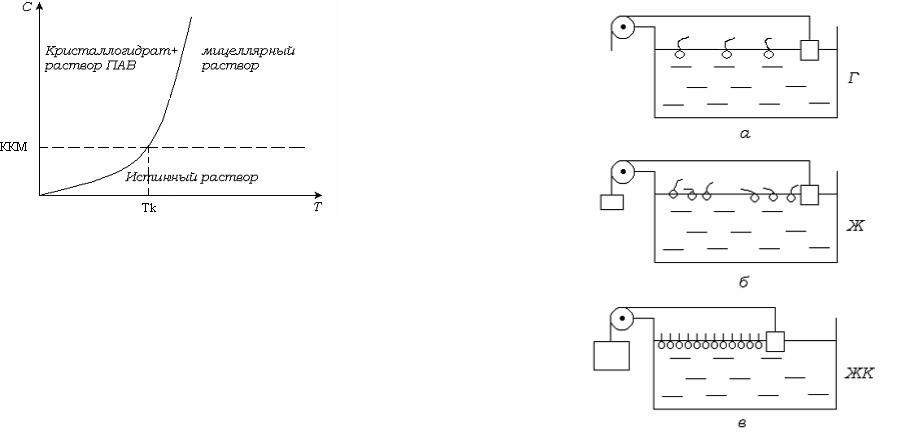
Рис. 7.6. Зависимость растворимости ионогенных ПАВ от температуры.
Точка Крафта наряду с ККМ является важной физико-химической характеристикой ПАВ. Величина ККМ характеризует нижний предел
концентрации, а Tk - нижний предел температуры существования мицеллярных растворов.
С повышением температуры растворимость медленно увеличивается, и при температуре Крафта достигает критической концентрации мицеллообразования. В форме мицелл может быть диспергировано относительно большое количество ПАВ, вследствие чего наблюдается сильное увеличение растворимости. Температурная зависимость растворимости выше точки Крафта называется линией
Крафта. Ниже Tk существует равновесие между кристаллогидратами ПАВ и истинным раствором ПАВ, концентрация которого медленно
растет с температурой. Выше Tk существует равновесие между мицеллярным раствором и истинным раствором, концентрация которого остаётся постоянной.
70
Рис.5.6. Агрегатные состояния поверхностных пленок ПАВ.
Под действием сравнительно небольшой силы на плавучий барьер монослой переходит в жидкое состояние. Молекулы ПАВ на поверхности группируются и образуют островки (рис. 5.6, б). При дальнейшем увеличении действующей на барьер силы, т. е. уменьшении площади, занимаемой молекулой ПАВ, монослой переходит в жидко-кристаллическое состояние (рис. 5.6, в).
15
www.mitht.ru/e-library
5.6.Уравнение состояния двумерного газа
Вдвумерном газе действует поверхностное давление, которое является растягивающим, в противоположность поверхностному
натяжению, сжимающему поверхность. Это давление равно
0 . При малом содержании ПАВ, т.е. в состоянии двумерного газа 0 K C . После дифференцирования получим:
|
d d K dC |
|
|
(5.12) |
|||||
Подставим уравнение (5.12) в уравнение Гиббса: |
|
||||||||
Г |
C |
|
d |
|
C K |
|
|
|
(5.13) |
R T |
dC |
|
R T |
||||||
|
|
|
R T |
|
|||||
Площадь, занимаемую одним молем ПАВ, обозначим через sм .
Тогда
Г |
1 |
; |
1 |
|
|
|
sм |
|
R T |
||||
|
|
sм |
||||
sм |
R T |
(5.14) |
||||
Это уравнение состояния двумерного газа аналогично уравнению газа P V R T .
Для реального двумерного газа справедливо уравнение Фрумкина, аналогичное уравнению Ван-дер Ваальса:
( |
|
) (sм ) R T |
(5.15) |
|
|||
|
sм2 |
|
|
где - константа взаимодействия молекул ПАВ в поверхностном слое, - эффективная площадь сечения молекулы.
В конденсированных пленках молекулы ПАВ находятся в виде отдельных островков (жидкие пленки) или частокола Ленгмюра (твердые пленки).
16
Количественной оценкой гидрофобного взаимодействия является изменение энергии Гиббса при переходе углеводородного радикала из воды в мицеллу ( 8,8 кДж/ мольдля CH и 2,9 кДж/ моль для
CH 2 групп).
Вещества с гидрофобными группами нарушают структуру воды и увеличивают свободную энергию системы. Возможны два пути снижения свободной энергии. Первый путь – это адсорбция, когда молекулы ПАВ концентрируются на поверхности и контакт гидрофобных групп с водой уменьшается. Второй, альтернативный путь - это агрегация молекул ПАВ, т. е. мицеллообразование. При образовании мицелл также устраняется контакт гидрофобных групп с водой и снижается свободная энергия системы.
7.8. Зависимость растворимости ПАВ в воде от температуры
Растворимость ионогенных ПАВ в воде вначале медленно, а затем быстро увеличивается с повышением температуры, их фазовое состояние определяется точкой Крафта (1895г.). Это объясняется тем, что неассоциированные ПАВ имеют низкую растворимость, а мицеллы хорошо растворимы. Ниже температуры Крафта растворимость ПАВ недостаточна для мицеллообразования (рис. 7.6) .
69
www.mitht.ru/e-library
