
- •Федеральное агентство по образованию
- •им. М. В. Ломоносова
- •И. А. Туторский
- •5. Адсорбция на границе раствора с газом
- •5.1. Поведение растворенных веществ на границе раствора с газом
- •5.2. Поверхностная активность
- •5.3. Поверхностно – инактивные вещества
- •5.4. Вывод адсорбционного уравнения Гиббса
- •5.5. Строение адсорбционного слоя ПАВ на границе раствора с газом
- •5.6. Уравнение состояния двумерного газа
- •5.7. Диаграммы состояния поверхностных пленок
- •5.8. Химические реакции в поверхностных пленках
- •5.9. Самоорганизованные монослои и пленки, перенесенные на твердую подложку с поверхности вода-воздух (пленки Ленгмюра –Блоджетт)
- •5.10. Двухсторонние пленки
- •5.11. Вид изотермы поверхностного натяжения. Уравнение Шишковского
- •5.12. Связь уравнений Ленгмюра и Гиббса с помощью уравнения Шишковского
- •5.13. Вывод уравнения Ленгмюра при совместном решении уравнений Гиббса и Шишковского
- •5.14. Правило Траубе
- •6. АДСОРБЦИЯ НА ГРАНИЦЕ РАЗДЕЛА ТВЕРДОЕ ТЕЛО – РАСТВОР
- •6.1. Введение
- •6.2. Правило вытеснения
- •6.3. Когезия и адгезия
- •6.4. Смачивание и растекание
- •6.5. Практическое значение смачивания
- •6.6. Правило выравнивания полярностей
- •6.7. Адсорбция полимеров из растворов на твердой поверхности
- •7. Коллоидные ПАВ
- •7.1. Введение
- •7.2. Производство и применение ПАВ
- •7.3. Биоразлагаемость и токсичность
- •Рис. 7.1. Биоразлагаемость анионных ПАВ. 1-тетрапропиленбензолсульфонат натрия, 2-линейный алкилбензолсульфонат, 3-алкилсульфат
- •7.4. Классификация и общая характеристика ПАВ
- •7.5. Свойства водных растворов ПАВ. Мицеллообразование
- •Рис. 7.3. Строение сферической мицеллы ПАВ в воде.
- •7.6. Влияние различных факторов на ККМ
- •7.6.1. Влияние длины углеводородного радикала
- •7.6.2. Влияние строения углеводородного радикала
- •7.6.3. Влияние добавок электролитов
- •7.6.4. Влияние полярных органических веществ
- •7.7. Термодинамика мицеллообразования в водной среде
- •7.8. Зависимость растворимости ПАВ в воде от температуры
- •7.9. Мицеллообразование в неводных средах
- •7.10. Оценка дифильных свойств ПАВ
- •7.11. Солюбилизация
- •7.12. Физико-химия моющего действия
- •7.13. Смеси ионных и неионных ПАВ
- •Содержание
положительное изменение энтропии, обусловленное разрушением упорядоченного расположения молекул воды вокруг углеводородных радикалов при их ассоциации.
7.6.2. Влияние строения углеводородного радикала
Величина ККМ при равном количестве атомов возрастает (по сравнению с парафиновой цепью): а) при включении циклов в цепь (алкилсульфонаты по сравнению с алкилбензолсульфонатами); б) при введении в углеводородный радикал полярных групп, гетероатомов (олеат натрия по сравнению с рициноолеатом натрия). Наличие ароматических циклов, кратных связей, гетероатомов приводит к уменьшению гидрофобности углеводородного радикала и следовательно к повышению ККМ.
7.6.3. Влияние добавок электролитов
Введение электролитов в раствор ПАВ снижает величину ККМ по различным причинам. Во-первых, электролит уменьшает гидратацию полярных групп ионов ПАВ, так как он связывает воду за счёт гидратации своих ионов. Уменьшение гидратации иона ПАВ повышает их склонность к ассоциации. Во-вторых, добавленный электролит уменьшает эффективную степень диссоциации поверхностноактивного электролита как в истинном растворе, так и в мицеллярном состоянии.
7.6.4. Влияние полярных органических веществ
Их введение в раствор ПАВ заметно влияет на ККМ. Характер влияния зависит от длины углеводородного радикала. Так длинноцепочечные спирты уменьшают ККМ, одновременно возрастает размер образующихся мицелл и вязкость раствора ПАВ. Эти факты объясняются образованием смешанных мицелл ПАВ+спирт.
66
5.8. Химические реакции в поверхностных пленках
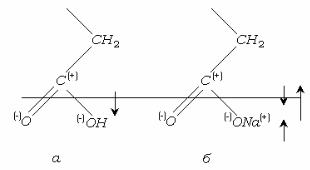
Поверхностные пленки обладают электрическим зарядом, который влияет на химические реакции, идущие по ионному механизму. К таким реакциям относится большинство жизненно важных биохимических каталитических реакций (ферментативный синтез, протеолиз, лактонизация кислот, омыление жиров).
Введение в поверхностную пленку веществ, вызывающее изменение величины или знака ее электрического потенциала, может изменить скорость химической реакции в пленках на несколько порядков. Заряд поверхности изменяет свою величину, и знак при переходе от пленок жирных кислот к пленкам, которые образуют их соли (рис.5.9) .
Пленки жирных кислот, спиртов, сложных эфиров со стороны газовой фазы обладают положительным зарядом вследствие избытка электронной плотности на атомах кислорода (рис. 5.9).
Рис. 5.9.
Соли жирных кислот образуют отрицательно заряженные пленки, так как диполь карбоксильной группы перекрывается большим по величине и противоположным по направлению диполем ионной пары.
19
www.mitht.ru/e-library
