- •Глава 9. Бензол. Ароматичность. Углеводороды ряда бензола
- •9.1. Строение бензола
- •Тепловой эффект реакции гидрирования бензола составляет
- •9.2. Номенклатура и изомерия аренов
- •9.3. Строение аренов
- •9.3.1. Строение толуола
- •9.3.2. Строение винилбензола
- •9.4. Физические свойства
- •9.5. Химические Свойства
- •9.5.1. Химические свойства бензола
- •9.5.2. Химические свойства аренов
- •9.6. Способы получения
- •9.7. Физиологическое действие и важнейшие представители аренов
- •9.8. Небензоидные ароматические системы
- •Вопросы и упражнения
9.5.2. Химические свойства аренов
Природа таких заместителей в бензольном кольце может быть различной: они могут быть насыщенными, а могут содержать одну или несколько по-разному расположенных кратных связей. Всё это может сильно влиять на поведение данного углеводорода в тех или иных реакциях. Здесь будут рассмотрены наиболее типичные превращения соединений с заместителями, не содержащих кратных связей и содержащих двойную связь у -углеродного атома.
9.5.2.1. Реакции электрофильного замещения
Как показано в химических свойствах бензола, реакции электрофильного замещения (SE) в ароматическом ряду занимают наиболее значимое место. В связи с этим механизм реакций, общие закономерности и условия их протекания для различных ароматических соединений подробно рассмотрены в главе 10.1.2.
Для алкилбензолов характерны те же электрофильные реакции, что и для незамещённого бензола. Это прежде всего нитрование, сульфирование, галогенирование, алкилирование и ацилирование. Продуктами этих реакций могут быть различные функциональные производные аренов, в связи с чем такие реакции могут использоваться как способы получения разнообразных ароматических соединений.
Однако при рассмотрении реакций электрофильного замещения необходимо иметь в виду, что, так как алкильные группы обладают электронодонорными эффектами по отношению к бензольному кольцу, то взаимодействие таких соединений с электрофилами будет протекать легче, чем незамещённого бензола. Это выражается в возрастании скорости реакции и замещении, как правило, не одного, а нескольких водородных атомов кольца. Кроме того, следует иметь в виду, что в молекулах алкилбензолов электронная плотность распределена неравномерно по бензольному кольцу. Поэтому подвергаться электрофильной атаке будут атомы углерода кольца с повышенной электронной плотностью.
|
|
|
|
-комплекс
|
-комплекс
Если в реакцию вступает моноалкилзамещённый бензол, то в результате электрофильного замещения образуются о- и п-дизамещённые бензолы, а при протекании реакции до конца — продукт исчерпывающего замещения:

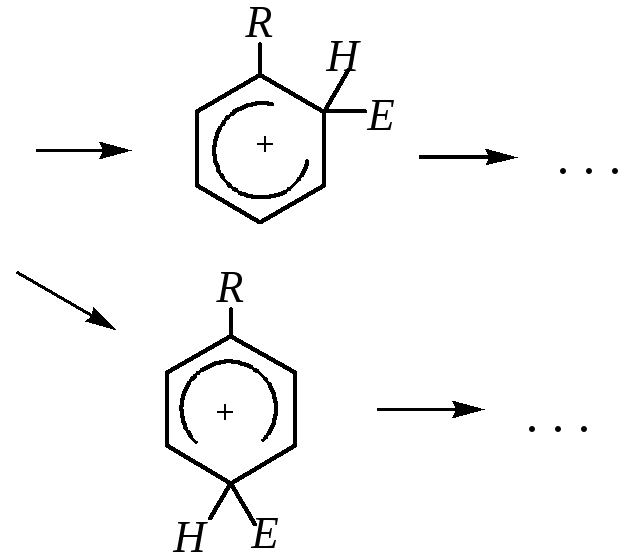
С другой стороны, в реакциях замещения ориентирующее направление алкильной группы в орто- и пара-положениях бензольного кольца может быть объяснено и динамическим подходом, то есть сравнением устойчивости образующихся -комплексов. Рассмотрим образование -комплексов на примере взаимодействия с электрофильной частицей молекулы толуола. При образовании -связи между электрофилом и углеродным атомом, находящимся в орто-, мета- или пара-положении бензольного кольца, образуются соответственно три -комплекса, строение которых описывается следующими граничными структурами:

Как видно, в случаях вступления электрофила в о- и п-положения число граничных структур данных -комплексов больше, чем при вступлении электрофила в м-положение бензольного кольца (четыре против трёх). К тому же среди о- и п-изомеров присутствуют такие структуры, в которых подчёркивается участие электронодонорной (метильной) группы в делокализации положительного заряда -комплекса, — это последние из изображённых в соответствующих рядах структур. Всё это подтверждает, что направление электрофильной атаки в о- и п-положения бензольного кольца энергетически выгоднее атаки в м-положение.
Однако необходимо иметь в виду, что о- и п-ориентация определяет лишь преимущественное направление реакции электрофильного замещения в алкилбензолах, то есть замещение идёт в эти положения бензольного кольца преобладающим образом, но не исключительно. Обычно образуется смесь всех трёх изомеров (орто-, мета-, пара-), но они находятся в разных соотношениях. Доля м-изомера определяется, главным образом, силой ориентирующего влияния алкильной группы R в бензольном кольце. Чем больше число атомов водорода при -углеродном атоме, тем выше значение электронной плотности на кольце (эффект Натана–Бейкера*). Это может быть объяснено величиной эффекта сверхсопряжения данной алкильной группы с ароматическим кольцом. По мере уменьшения проявляемого эффекта --сопряжения алкильные группы располагаются в следующем порядке:
-CH3 > -CН2СН3 > -CH(CH3)2 > -C(CH3)3 ,
так как число -водородных атомов в этом ряду уменьшается от 3 до 0. При этом уменьшается реакционная способность соединений с такими заместителями (от толуола дотрет-бутилбензола). Но кроме того, силао-п-ориентирующего влияния тоже ослабевает, то есть доляо- и п-изомеров несколько уменьшается и увеличивается относительное количество продуктам-замещения. Но даже для реакций с участием толуола доля образующегосям-изомера может достигать 10%. Поэтому метильную и другие алкильные группы называют слабыми ориентантами.
Нитрование — один из примеров реакций электрофильного замещения в ароматическом кольце.
Так, при мононитровании толуола образуется 58%о-изомера и38%п-изомера. При дальнейшем нитровании смеси нитротолуолов при 350Кполучается смесь изомеров с преобладанием 2,4-динитротолуола. В смеси содержится также заметное количество 2,6-динитротолуола. Для нитрования динитротолуолов в 2,4,6-тринитротолуол (тротил) применяют безводную смесь серной и азотной кислот с двойным избытком азотной кислоты по сравнению с теоретически необходимым. Нитрование проводят при температуре около 370К.

Другой пример SE-реакций алкилбензолов — алкилирование по Фриделю–Крафтсу. Эта реакция среди других реакций ароматического замещения наиболее неселективна: кроме моноалкилированного, образуются ди- и полиалкилзамещённые соединения.

Реакция Фриделя–Крафтса обратима, поэтому при нагревании протекает перегруппировка о- и п-диалкилбензолов в термодинамически более устойчивый м-диалкилбензол:

Следует заметить, что углеводороды с непредельными связями в боковой цепи взаимодействуют с электрофилами прежде всего по этим связям, а не по бензольному кольцу. Такое направление обусловлено тем, что электрофильное присоединение с сохранением ароматичности протекает значительно легче, чем замещение в бензольном кольце:

9.5.2.2. Восстановление бензольного кольца по Бёрчу
Как и сам бензол, алкилбензолы могут быть восстановлены до циклодиенов действием щелочных металлов и спирта в среде жидкого аммиака. При этом селективно образуются 1-алкилциклогексадиены-1,4, как это следует из механизма реакции, протекающей через образование наиболее стабильной структуры анион-радикала:


1-алкилциклогексадиены-1,4
9.5.2.3. Реакции боковых цепей
Химические реакции, протекающие с участием углеводородных заместителей, определяются прежде всего природой этих заместителей, а также влиянием на них -электронного секстета ароматического кольца. Поэтому должно наблюдаться существенное различие в химическом поведении соединений с предельными и непредельными боковыми цепями.
Радикальное замещение
В алифатическом ряду SR-реакции характерны главным образом для алканов. Поэтому аналогично алканам для аренов, содержащих насыщенные углеводородные заместители, в условиях свободнорадикальных реакций (облучение, нагревание) наблюдаются реакции замещения в боковой цепи. Общий механизм радикального замещения включает те же стадии, что и в случае радикального замещения в алканах: инициирование, рост цепи, обрыв цепи (гл. 2.4.1). Однако влияние бензольного кольца на алкильный радикал приводит к одной особенности: всегда замещается -водородный атом (если он имеется). Такая селективность — существенное отличие от реакции радикального замещения алканов.
Так, например, галогенирование любого алкилбензола приводит к образованию -галогенозамещённого и является распространённым способом получения галогенозамещённых аренов с атомом галогена у -углеродного атома боковой цепи:

Причина такого направления реакции кроется во влиянии бензольного кольца на стабильность образующегося алкильного радикала.


Образующиеся таким образом радикалы бензильного типа значительно устойчивее третичного, вторичного и тем более первичного радикалов, не сопряжённых с бензольным кольцом. В результате р--сопряжения происходит делокализация спиновой плотности радикала бензильного типа. Истинное строение радикала можно представить как промежуточное между пятью граничными структурами:

Электрофильное и радикальное присоединение
Реакции электрофильного присоединения (АdЕ) характерны для углеводородов, содержащих кратные связи в боковой цепи. При этом наиболее существенно влияние бензольного кольца на химическое поведение таких соединений, молекулы которых содержат двойную связь в -положении к ароматическому кольцу. Например, гидрогалогенирование таких соединений протекает селективно и приводит только к одному продукту — -галогенопроизводному:

Именно такое направление присоединения объясняется устойчивостью образующегося карбокатиона (-комплекса) при присоединении электрофильной частицы к молекуле субстрата.

Только катион бензильного типа будет стабилизирован р--сопряжением, и положительный заряд этого катиона делокализован с участием -электронной системы бензольного кольца. Истинное строение такого катиона является промежуточным между пятью граничными структурами:

Присоединение в присутствии пероксидов (по механизму АdR) протекает, как это следует из рассмотрения механизма реакции, с образованием -галогенопроизводного (гл. 4.1.2).
Дегидрирование, окисление
Дегидрирование характерно для насыщенных боковых цепей, протекает при повышенной температуре (800—900 К) на поверхности катализаторов; для этих целей используются оксиды магния, кальция, алюминия. При этом образование -связи в -положении к бензольному кольцу термодинамически выгодно, так как в этом случае возникает --сопряжённая система.

Окислению перманганатом или дихроматом калия могут подвергаться углеводороды с любыми алкильными заместителями в бензольном кольце, хотя ни алканы, ни бензол не окисляются подобным образом. Так, алкилбензолы, имеющие -водородный атом, окисляются до бензойной кислоты при кипячении в течение нескольких часов. Независимо от длины и строения алкильного радикала образуются карбоновые кислоты с карбоксильной группой, связанной с бензольным кольцом. Например:


Каталитическое окисление кислородом воздуха приводит к тем же продуктам, и в данном случае механизм реакции — радикальный и связан с участием образующегося радикала бензильного типа, из которого в качестве промежуточного продукта образуется -гидропероксид:


Данный процесс катализируется солями некоторых металлов переменной валентности (в частности Co3+).
Арены с кратными связями в боковых цепях подвергаются окислению аналогично этиленовым и ацетиленовым углеводородам (гл. 4.1.4.3). При действии озона на такие углеводороды реакция протекает одновременно как по кратной связи боковой цепи, так и по бензольному кольцу. Окисление озоном гомологов бензола протекает так же, как и для бензола (гл. 9.5.1.4).