
- •Теоретические основы химии
- •Основные понятия и законы химии Атомно - молекулярное учение.
- •Закон сохранения массы веществ
- •Составление химических уравнений
- •Расчеты по химическим уравнениям
- •Закон постоянства состава
- •Закон кратных отношений
- •Закон объемных отношений
- •Закон Авогадро и молярный объем газа
- •Следствия.
- •Закон эквивалентов
- •Основные классы неорганических
- •2. Разложение некоторых кислородсодержащих веществ (оснований, кислот, солей) при нагревании:
- •Основания
- •Получение оснований
- •Химические свойства оснований
- •Кислоты
- •Классификация кислот
- •Химические свойства кислот
- •Получение кислот
- •Средние соли
- •Химические свойства солей
- •Кислые соли
- •Графическое изображение формул
- •Энергетика химических реакций
- •Химическое равновесие. Константа химического равновесия
- •Энтропия
- •Энергия Гиббса направленность химических процессов
- •Примеры термодинамических расчетов
- •Полученные значения h и s характеризуют процесс испарения SnBr2. Процесс эндотермический, испарение требует нагревания. При испарении энтропия увеличивается.
- •Химическая кинетика. Скорость химической реакции
- •Молекулярность элементарных реакций
- •Уравнение Аррениуса
- •Катализ
- •Смещение химического равновесия
- •3 Влияние температуры на положение равновесия
- •Фазовые равновесия
- •Основные характеристики растворов
- •Растворимость газов в газах
- •Растворимость газов в жидкостях
- •Взаимная растворимость жидкостей
- •Растворимость твердых веществ в жидкостях
- •Растворы неэлектролитов
- •1. Давление насыщенного пара разбавленных растворов
- •2. Давление пара идеальных и реальных растворов
- •3. Температура кристаллизации разбавленных растворов
- •4. Температура кипения разбавленных растворов
- •5. Осмотическое давление разбавленных растворов
- •6. Понятие активности растворенного вещества
- •Слабые электролиты. Константа диссоциации
- •Сильные электролиты
- •PН растворов
- •Произведение растворимости
- •Гидролиз солей
- •Количественные характеристики процесса гидролиза соли.
- •Комплексные соединения
- •Направленность реакций в растворах электролитов
- •Протонная теория Брёнстеда-Лоури
- •В случае взаимодействия нейтральных молекулпродукт реакции (например bf3∙nh3) часто называют аддуктом.
- •Теория сольвосистем
- •Металлы, как типичные восстановители, окисляются до соединений, содержащих атомы металлов в более высоких степенях окисления, в зависимости от природы металла и характера среды:
- •Электродные потенциалы
- •Гальванические элементы
- •Электролиз
- •Законы электролиза
- •Примеры электролиза Расплавы
- •Растворы
- •Хими́ческие исто́чники то́ка
- •Коррозия металлов и методы защиты металлов от коррозии
- •Электрохимическая коррозия
- •Защита металлов от коррозии
- •Строение атома
- •Волновое уравнение. Квантовомеханическое объяснение строения атома
- •Электронная структура атомов и периодическая система элементов
- •Структура периодической системы элементов д.И. Менделеева.
- •Периодичность свойств химических элементов и их соединений
- •Ковалентная связь. Метод валентных связей
- •Способы образования ковалентной связи
- •Гибридизация атомных орбиталей
- •Метод молекулярных орбиталей
- •Ионная связь
- •Водородная связь
- •Квантовомеханические теории строения комплексных соединений
- •1. Теория валентных связей
- •2. Гибридизация орбиталей и структура комплексов
- •3. Теория кристаллического поля.
- •4. Цветность комплексных соединений
Энергетика химических реакций
Химическая термодинамика - это область химии, изучающая химические реакции, фазовые переходы, а также превращения энергии в различных химических процессах, направление и пределы их самопроизвольного протекания.
Основным объектом изучения термодинамики является система, под которой понимают совокупность объектов, отделенную от всех других, которая подвергается теоретическому или экспериментальному изучению. Внешняя среда – объекты, окружающие систему. Границы между системой и внешней средой могут быть как физически действительными, так и условными.
Система бывает:
открытой, если через границу, разделяющую систему и внешнюю среду, может происходить обмен веществом и энергией (например, жидкость и ее пар).
закрытой, если она может обмениваться с внешней средой энергией и не может обмениваться веществом (например, газ в баллоне).
изолированной, есистема не в состоянии обмениваться в внешней средой ни веществом, ни энергией. (например, запаянная ампула, полностью изолированная от внешней среды).
Обмен энергией между системой и внешней средой может осуществляться в различных формах: тепловая, механическая, электрическая энергия, энергия излучения (указанные формы могут превращаться друг в друга). В превращениях, протекающих в ходе химических реакций, участвуют, как правило, тепловая энергия Q и механическая (или работа) А. Теплота и работа измеряются в джоулях (Дж), килоджоулях (кДж), мегаджоулях (МДж) и т.д.
При протекании химических реакций изменяется энергетическое состояние системы, в которой идет эта реакция. Состояние системы определяется параметрами состояния (давление (р), температура ( Т ), объем ( V ), химическое количество вещества (п ), состав системы и др.). Экстенсивные параметры зависят от количества вещества, находящегося в системе (масса, оъем, энергия). Интенсивные параметры не зависят от количества вещества, находящегося в системе (температура, плотность, давление). Состояние системы и происходящие в ней изменения характеризуются функциями состояния (внутренняя энергия (U), энтальпия (Н ), энтропия (S), энергия Гиббса (G ) и др.), зависящими от параметров состояния системы и не зависящих от пути перехода системы из одного состояния в другое.
В термодинамике свойства системы рассматриваются при ее равновесном состоянии. Термодинамическое состояние системы называют равновесным в том случае, когда его термодинамические параметры одинаковы во всех точках системы и не изменяются самопроизвольно (без затраты работы) во времени.
Термодинамика изучает переходы системы из одного состояния в другое. Но переходы должны осуществляться при термодинамическом равновесии с окружающей средой, т.е. очень медленно, а в идеале - бесконечно медленно. При этом могут изменяться все параметры состояния системы, либо некоторые параметры остаются без изменения. Если процессы перехода системы происходят при постоянстве каких-то параметров системы, то они называются:
а) изобарическими (р = const);
б) изохорическими (V= const);
в) изотермическими (Т= const);
г) изобарно-изотермическими (р = const, Т= const) и т.д.
Под внутренней энергией системы (U) в термодинамике понимают ее полную энергию, которая складывается из энергии поступательного, колебательного и ·вращательного движения, энергии притяжения и отталкивания всех частиц системы, исключая потенциальную энергию ее положения и кинетическую энергию движения системы как целого. Поскольку не определен условный нуль для внутренней энергии, то установить можно лишь ее изменение как разность значений внутренней энергии системы в конечном U2 и начальном U1 состоянии, т.е.
ΔU = U2 – U1 ,
где U2 и U1 - внутренняя энергия системы в конечном и начальном состояниях.
Если в ходе химической реакции внутренняя энергия системы понижается (ΔU < О ), то происходит выделение некоторого количества теплоты во внешнюю среду (экзотермическая реакция). Если же внутренняя энергия системы повышается (ΔU > 0), то реакционная система поглощает энергию из внешней среды (эндотермическая реакция). Чем больше изменение внутренней энергии, тем значительнее по величине тепловой эффект реакции.
Изменение внутренней энергии можно измерить с помощью работы и теплоты, так как система может обмениваться с окружающей средой веществом или энергией в форме теплоты Q и работы А.
Теплота Q представляет собой количественную меру хаотического движения частиц данной системы или тела. Энергия более нагретого тела в форме теплоты передается менее нагретому телу. При этом не происходит переноса вещества от одной системы к другой или от одного тела к другому.
Работа А является количественной мерой направленного движения частиц, мерой энергии, передаваемой от одной системы к другой за счет перемещения вещества от одной системы к другой под действием тех или иных сил, например гравитационных.
Положительной (А > О) считается работа, совершаемая системой против действия внешних сил, и теплота (Q > О), подводимая к системе. В отличие от внутренней энергии, работа и теплота зависят от способа проведения процесса, т.е. они являются функциями пути.
Количественное соотношение между изменением внутренней энергии, теплотой и работой устанавливает первый закон термодинамики:
Q = ΔU + А (1)
Выражение (1) означает, что теплота, подведенная к системе, расходуется на приращение внутренней энергии системы и на работу системы над окружающей средой.
Первый закон термодинамики является формой выражения закона сохранения энергии. Согласно этому закону, энергия не может ни создаваться, ни исчезать, но может превращаться из одной формы в другую.
Энтальпия системы и ее изменение. Работу А можно разделить на два слагаемых: работу расширения pΔV (p = const) и другие виды работ A', кроме работы расширения:
А= А' + pΔV, (2)
где р - внешнее давление; ΔV - изменение объема (ΔV = V2 – V1); V2 - объем продуктов реакции; V1 - объем исходных веществ. Соответственно уравнение (1) при постоянном давлении запишется в виде:
Qp = ΔU + А' + pΔV . (3)
Если на систему не действуют никакие другие силы, кроме постоянного давления, т.е. при протекании химического процесса единственным видом работы является работа расширения, то А' =0.
в этом случае уравнение (3) запишется:
Qp = ΔU + pΔV (4)
Подставив ΔU = U2 – U1 получим:
Qp = U2 – U1 + pV2 - pV1 = (U2 + pV2) - (U1 + pV]). (5)
Характеристическая функция
U + pV =Н (6)
называется энтальпией системы. Энтальпия – теплосодержание, т.е. количество теплоты, которое необходимо придать системе, чтобы перевести ее от абсолютного нуля (Т=0 К) до заданной температуры. Энтальпия - одна из термодинамических функций, характеризующих систему, находящуюся при постоянном давлении. Подставив уравнение (6) в (5), получим:
Qp = Н2 – Н1 = ΔН. (7)
Как видно из уравнения (7), в случае изобарического процесса (р= const), теплота, подведенная к системе, равна изменению энтальпии системы. Как и другие характеристические функции, энтальпия зависит от количества вещества, поэтому ее изменение (ΔН), обычно относят к 1 моль и выражают в кДж/моль.
Изменение энергии системы при протекании в ней химической реакции при условии, что система не совершает никакой другой работы, кроме работы расширения, называется тепловым эффектом химической реакции (энтальпией реакции).
Если система находится в изохорических условиях (V= const, ΔV= 0), то из уравнения (3) следует:
Qv= ΔU, (8)
Т.е. в этом случае тепловой эффект химической реакции равен изменению внутренней энергии системы.
Поскольку в большинстве случаев химические реакции протекают при постоянном давлении, то в дальнейшем, кроме особо оговоренных исключений, будут рассмотрены изобарические условия. Тепловой эффект реакции будем называть также энтальпией реакции и обозначать ΔН. Если исходные вещества и продукты реакции находятся в стандартном состоянии, то тепловой эффект реакции называется стандартной энтальпией реакции обозначается ΔНо. За стандартное состояние вещества принимают такое его физическое состояние, в котором чистое вещество наиболее устойчиво при давлении 1 атм и определенной температуре. Температура может быть любой постоянной, но чаще всего это 298 К.
Условия стандартного состояния веществ
|
Состояние вещества |
Стандартное состояние вещества |
|
Простое твердое вещество |
Кристаллическое твердое вещество |
|
Простое жидкое вещество |
Чистая жидкость |
|
Газообразное |
Парциальное давление 101, 325 кПа (1 атм) |
|
Растворенное |
Концентрация·· 1 моль/л (активность 1 моль/л) |
Стандартное состояние веществ не зависит от температуры. Если в результате реакции теплота выделяется, т.е. энтальпия системы понижается- (ΔН < О), то реакция называется экзотермической. Реакция, протекающая с поглощением теплоты, т.е. с повышением энтальпии системы (ΔН > О), называется эндотермической. Основные эндотермические и экзотермические физические и химические процессы, с которыми наиболее часто приходится сталкиваться при решении термодинамических задач приведены в табл. 2.
Таблица 2
|
Процесс |
ТепловоЙ эффект | |
|
эндотермический |
экзотермический | |
|
Физический | ||
|
Плавление |
х |
|
|
Испарение |
х |
|
|
Возгонка |
х |
|
|
Адсорбция |
|
х |
|
Десорбция |
х |
|
|
Абсорбция |
х |
|
|
Жидкокристаллический переход |
х |
|
|
Химический | ||
|
Диссоциация |
х |
|
|
Атомизация |
х |
|
|
Ионизация |
х |
|
|
Присоединение электрона к нейтральной частице (сродство к электрону) |
|
х |
|
Образование вещества из атомов |
|
х |
|
Образование кристаллической решетки |
|
х |
|
|
|
|
|
Разрушение кристаллической решетки |
х |
|
|
Хемосорбция |
|
х |
|
Десольватация |
х |
|
|
Дегидратация |
х |
|
|
Разложение |
х |
х |
|
Окислительная деструкция |
|
х |
|
Окисление в газовой атмосфере |
|
х |
|
Восстановление в газовой атмосфере |
х |
|
|
Реакции окисления-восстановления |
х |
х |
|
Реакции в твердой фазе |
х |
х |
|
Горение |
|
х |
|
Полимеризация |
|
х |
|
Отверждение смол |
|
х |
|
Каталитические реакции |
|
х |
Тепловой эффект реакции зависит (хотя и относительно мало) от температуры; поэтому в индексе обычно указывается температура ΔНот, или ΔНо298 . Зависимость изменения энтальпии от температуры может быть представлена следующим выражением (так называемый закон Кирхгофа):
ΔН2 = ΔН1 + Т1Т2 ∫ ΔСр dT,
Где ΔСр – изменение теплоемкости системы.
Теплоемкость – количество теплоты, необходимое для нагревания единицы массы вещества на 1 К. Для аналитических вычислений обычно пренебрегают зависимостью теплоемкости от температуры, т.е. считают, что ΔСр ≈ ΔСр298. В этом случае закон Кирхгоффа будет иметь вид:
ΔН2 = ΔН1 + ΔСр298 (Т2 – Т1 ),
Если принять допущение, что сумма теплоемкостей начальных и конечных продуктов равны, т.е. ΔСр = 0, , следовательно
ΔН2 = ΔН1 = const. , т.е. тепловой эффект не зависит от температуры.
Действительно, учет зависимости изменения энтальпии реакции от температуры актуален для точных термодинамических вычислений. В ряде случаев зависимостью изменения энтальпии химической реакции от температуры можно пренебречь. Для большинства реакций изменение теплового эффекта в пределах температур, имеющих практическое значение, относительно невелико. Например, тепловой эффект реакции окисления графита: (С + СО2 = 2 СО) при увеличении температуры с 500 до 1500 К изменяется на 5%, а реакции окисления азота (½ N2 + ½ О2 = NO) при повышении температуры с 298 до 4000 К - лишь на 2,2%. Поэтому в дальнейшем будут использоваться значения ΔНо298 и в расчетах значения ΔНо считаться постоянными:
Н ≈
Н
≈
Н ,
,
На тепловой эффект также влияет давление. Однако, в пределах давлений, используемых в практике, эффект давления для большинства реакций относительно невелик. Например, при увеличении давления с 105 ДО 5·107 Па тепловой эффект реакции синтеза аммиака:
N2 + 3Н2 = 2NНз
изменяется на 5%. Поэтому в дальнейшем в расчетах влияние давления на энтальпию реакции не будет учитываться, а будут использоваться стандартные значения энтальпий реакций (ΔНо).
Стандартная энтальпия (теплота) образования. Тепловой эффект образования 1 моля вещества из простых веществ, устойчивых при 298 К u давлении 101,325 кПа, называют стандартной энтальпией (теплотой) образования. Стандартную энтальпию образования вещества обозначают ΔНоf,298 .
Стандартную энтальпию образования простых веществ, устойчивых при 298 К и давлении 101,325 кПа, принимают равной нулю.
Нулевое значение энтальпии образования имеет фаза или модификация вещества, наиболее устойчивая при 298 К и давлении 100 кПа, например, газообразный кислород, жидкий бром, белый фосфор, белое олово, ромбическая сера. Например: ΔНоf,298(О2)=0 кДж/моль, но ΔНоf,298 (О3)=142,3 кДж/моль.
Тепловые эффекты реакций образования веществ в стандартном состоянии называют стандартными энтальпиями образования ΔНоf,298 . . Эти величины определены с той или иной степенью точности для нескольких тысяч веществ и приведены в справочниках. Если стандартная энтальпия образования отрицательна, соединение более устойчиво, чем простые вещества, из которых оно образовалось. Если она положительна, соединение менее устойчиво, чем простые вещества, образовавшие его.
Эндотермические соединения (ΔНоf,298 >0) неустойчивы и склонны к распаду. Получают их, как правило, косвенным путем.
В ряду однотипных соединений чем меньше ΔНоf,298, тем больше его термическая устойчивость относительно разложения на простые вещества. Так в ряду
ZnO (ΔНоf,298 = -350,6кДж/моль) - CdO (ΔНоf,298 = -260кДж/моль)-HgO(ΔНоf,298 = -90,9кДж/моль)
устойчивость соединений уменьшается.
Атомарная энтальпия образования вещества соответствует энтальпии образования 1 моля вещества из атомов.
Энтальпия сгорания вещества (ΔНосг,298 ) соответствует изменению энтальпии при сгорании в кислороде 1 моля вещества в его стандартном состоянии при температуре 298 К и давлении 1 атм. При этом продуктами сгорания органических веществ считают углекислый газ и воду; другие продукты принято указывать дополнительно.
(C3H6) + 9/2 (O2) → 3(CO2) + 3 {H2O}, ΔНосг,298 = -2219,7кДж
Стандартные молярные энтальпии сгорания некоторых соединений приведены в справочной литературе.
Стандартная энтальпия растворения - это изменение энтальпии при растворении 1 моля вещества с образованием бесконечно разбавленного раствора. При этом предполагается, что энтальпия не зависит от концентрации раствора.
Энтальпия сольватации (гидратации) характеризуется изменением энтальпии при сольватации (гидратации) 1 моля растворенного вещества.
Стандартная молярная энтальпия нейтрализации – изменение энтальпии при образовании 1 моля воды в результате нейтрализации каких-либо кислоты и щелочи при температуре 298 К и давлении 1 атм.
В случае нейтрализации сильной щелочи сильной кислотой Стандартная молярная энтальпия нейтрализации почти всегда равна -55,65 кДж/моль. Это объясняется тем, что любые реакции нейтрализации сильных кислот и сильных щелочей можно описать одним и тем же ионным уравнением
{H+} + {ОH-} → {H2O}, ΔНо298 = -55,65кДж/моль
Изменение фазового состояния вещества (например, плавление, испарение, сублимация) всегда приводит к изменению энтальпии. Температура, при которой происходит фазовое превращение называется температурой перехода.
Стандартной молярной энтальпией плавления ΔНо пл.,298 называется изменение энтальпии, которым сопровождается плавление одного моля данного вещества при его температуре плавления и давлении 1 атм. Например, для воды при температуре 273,2 К ΔНо пл.,298 = 6,01 кДж/моль.
Стандартной молярной энтальпией испарения ΔНо исп..,298 называется изменение энтальпии, которым сопровождается испарение одного моля данного вещества при его температуре кипения и давлении 1 атм. Например, для воды при температуре 373,2 К ΔНо пл.,298 = 41,09 кДж/моль.
Калориметрия.
Для измерения количества энергии, высвобождаемой или поглощаемой в результате химической реакции или физического превращения (для определения внутренней энергии, энтальпии, теплоемкости) используют специальные приборы – калориметры, которые представляют собой теплоизолированные сосуды. Типичный калориметрический эксперимент состоит в том, что энергия, выделяемая в результате химического превращения, передается воде или самой реакционной смеси, после чего измеряется повышение их температуры.
Приближенные измерения изменений энтальпий для реакций в растворах можно проводить с помощью простейшего калориметра, в качестве которого достаточно использовать стакан из полистирола, теплоемкость которого пренебрежительно мала.
Для определения энтальпий сгорания летучих жидкостей типа спиртов или жидких углеводов используют плазменный калориметр.
Для определения изменений энергии, которыми сопровождаются такие реакции, как горение, используют разновидность калориметра, который называют калориметрической бомбой (или бомбовый калориметр). Калориметрическая бомба – прочный герметически закрывающийся сосуд, окруженный теплоизолирующей водяной рубашкой. Образец с известной массой помещается внутри бомбы в атмосфере чистого кислорода под давлением порядка 25 атм. Затем образец поджигают при помощи электрической искры. Энергия, выделяющаяся в результате горения, передается водяной рубашке. В ходе эксперимента измеряют повышение температуры водяной рубашки.
Калориметрическую бомбу используют, например, для экспериментального определения калорийности пищи. Все мы поглощаем энергию в виде пищи и напитков. По сравнению с этим энергия, поступающая в наши тела в виде тепла пренебрежимо мала. Калорийность белого хлеба - 10 кДж/г, мороженого - 7 кДж/г, яблоки - 2 кДж/г. Энергия, которую мы поглощаем с пищей, расходуется главным образом тремя путями:
очень малая часть уходит в отходы вместе с испражнениями;
избыток запасается в виде образующегося в организме жира. 1 кг жира образуется за счет избыточно поглощаемой энергии, примерно равной 35000 кДж.
Расходуется организмом. Точное значение энергии, которую расходует человек, зависит от его возраста, пола, веса, роста, характера деятельности. Мужчины обычно поглащают ежедневно от 9200 до 12100 кДж, женщины – от 6700 до 8800 кДж, однако для занятых физическим трудом эти цифры могут быть выше.
Энергия расходуется человеческим организмом главным образом для осуществления следующих видов деятельности:
Химических превращениях в организме (метаболизм)
Для поддержания определенной температуры тела
Для выполнения мышечной работы. Расход энергии, кДж/мин: сидение -6, стояние – 10, ходьба – 16, бег – 40, метание копья и другие атлетические виды спорта - намного более 50.
Термохимические уравнения. Раздел химии, изучающий тепловые эффекты химических реакций и фазовых превращений, называется термохимией.
Уравнения процессов, в которых указаны тепловые эффекты, называются термохимическими. Тепловой эффект записывается либо непосредственно в уравнении реакции, например:
(N2 ) + 3(Н2) = 2(NНз) + 92 кДж
Или (N2 ) + 3(Н2) = 2(NНз), ΔНо298 = - 92 кДж
Чтобы отнести энтальпию реакции к одному молю какого-либо вещества, термохимические уравнения иногда имеют дробные коэффициенты:
2 Al + 3/2 O2 = Al2O3, ΔНо298 = - 1675,8 кДж
В некоторых случаях тепловой эффект относят к 1 моль какого-либо вещества, например: ΔНо298 = - 1675,8 кДж/моль.
В термохимических уравнениях записываются также агрегатные состояния или модификации исходных веществ и продуктов реакции:
(СО2)
+ [Cграфит] = 2(СО);Н = 172,47 кДж.
= 172,47 кДж.
Термохимические расчеты основаны на законе Гесса: тепловой эффект реакции при постоянных температуре и давлении зависит только от природы и состояния исходных и конечных веществ и не зависит от числа и характера промежуточных стадий. Иными словами, если химический процесс можно осуществить несколькими путями, то изменение энтальпии суммарного процесса будет равно сумме изменений энтальпий отдельных стадий (закон аддитивности теплот реакций):
ΔНо1
Сграфит
+ О2
СО2


ΔНо2 ΔНо3
СО + ½ О2
ΔНо1 = ΔНо2 + ΔНо3
Из закона Гесса следует, что термохимические уравнения можно складывать, вычитать, умножать на численные множители.
Задача. Вычислить теплоту образования СО, если известны тепловые эффекты реакций:
Сграфит
+ О2
→ СО2
Н 1
= -393,5 кДж/моль
1
= -393,5 кДж/моль
СО
+ ½ О2
→ СО2
Н 2=
-283,0 кДж/моль
2=
-283,0 кДж/моль
Сграфит
+ ½ О2
→ СО
Н 3
= -?
3
= -?
Последнее
уравнение получается, если из первого
вычесть второе. Следовательно
Н 3 =
Н
3 =
Н 1
- Н
1
- Н 2
= -110,5 кДж/моль.
2
= -110,5 кДж/моль.
Обычно
в термохимических расчетах применяют
первое 1-е
следствие
из закона Гесса:
тепловой
эффект реакции (Н )
равен сумме стандартных теплот образования
(Н
)
равен сумме стандартных теплот образования
(Н )
продуктов реакции за вычетом суммы
стандартных теплот образования исходных
веществ с учетом стехиометрических
коэффициентов:
)
продуктов реакции за вычетом суммы
стандартных теплот образования исходных
веществ с учетом стехиометрических
коэффициентов:
Н =
= –
– .
.
Обозначения:Н (Н
(Н )
–стандартное
изменение энтальпии в реакции (тепловой
эффект реакции).Н
)
–стандартное
изменение энтальпии в реакции (тепловой
эффект реакции).Н – стандартная
теплота (энтальпия) образования 1 моля
вещества из простых веществ.Н
– стандартная
теплота (энтальпия) образования 1 моля
вещества из простых веществ.Н –изменение
энтальпии в процессе образования 1 моля
вещества из простых веществ при условии,
что все участники реакции находятся в
стандартных состояниях. ВеличиныН
–изменение
энтальпии в процессе образования 1 моля
вещества из простых веществ при условии,
что все участники реакции находятся в
стандартных состояниях. ВеличиныН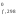 для
различных веществ приведены в справочной
литературе. Стандартные энтальпии
образования простых веществ приняты
равными нулю: Н
для
различных веществ приведены в справочной
литературе. Стандартные энтальпии
образования простых веществ приняты
равными нулю: Н (простых веществ) = 0.
(простых веществ) = 0.
Размерность
Н – кДж/моль;Н
– кДж/моль;Н –
кДж.
–
кДж.
При вычислении тепловых эффектов (изменения стандартных энтальпий) различных процессов необходимо:
записать соответствующий процесс, указав агрегатные состояния веществ, участвующих в реакции;
расставить стехиометрические коэффициенты;
выписать из справочника значения стандартных энтальпий образования Н
 всех участвующих в реакции веществ в
соответствующих агрегатных состояниях;
всех участвующих в реакции веществ в
соответствующих агрегатных состояниях;используя следствие из закона Гесса, рассчитать тепловой эффект (Н
 )
процесса. Стехиометрические коэффициенты
необходимо учитывать, так как энтальпия
является экстенсивной величиной.
)
процесса. Стехиометрические коэффициенты
необходимо учитывать, так как энтальпия
является экстенсивной величиной.
Задача 1. Рассчитать тепловой эффект (изменение энтальпии) реакции 4HCl+O2= 2Cl2+ 2H2Oв стандартных условиях.
Решение. Записываем уравнение реакции со стехиометрическими коэффициентами, обозначив агрегатные состояния веществ. Под формулой каждого из веществ выписываем из справочника значения стандартных энтальпий образования:
4(HCl) + (O2) = 2(Cl2) + 2(H2O)
Н ,
-92,4 0 0 –241,98 кДж/моль.
,
-92,4 0 0 –241,98 кДж/моль.
Используя следствие из закона Гесса, рассчитываем тепловой эффект реакции:
Н = 2Н
= 2Н (H2O)
+ 2Н
(H2O)
+ 2Н (Cl2)
– 4Н
(Cl2)
– 4Н (HCl)
– Н
(HCl)
– Н (O2)
= = 2
(–241,98) + 2
0 – 4(–92,4) – 0 = –114,36 кДж.
(O2)
= = 2
(–241,98) + 2
0 – 4(–92,4) – 0 = –114,36 кДж.
Рассматриваемый
процесс является экзотермическим (Н < 0).
< 0).
Задача 2. Рассчитать тепловой эффект процесса испарения воды:
Решение.{H2O} = (H2O)
H ,–285,84
–241,98 кДж/моль;
,–285,84
–241,98 кДж/моль;
H = (–241,98) – (–285,84) = 43,86 кДж.
= (–241,98) – (–285,84) = 43,86 кДж.
Процесс является эндотормическим.
Расчет изменения энтальпии процессов, протекающих в растворах
Тепловые эффекты реакций, протекающих в растворах, рассчитывают, используя сокращенные ионно-молекулярные уравнения соответствующих процессов. При расчете изменения энтальпий химических реакций, протекающих в растворах, используют стандартные энтальпии образования ионов - для диссоциирующих в воде соединений и стандартные энтальпии образования соединений - для тех веществ, которые не подвергаются диссоциации .
Стандартные
теплоты образования ионов
– величины относительные, так как
условно принято за ноль значение
стандартной энтальпии образования 1
моля иона водорода в 1 дм3
водного раствора в стандартных условиях
(давление 1 атм (101,32 кПа) и температура
298 К ). Стандартные энтальпии образования
других ионов определены относительно
стандартной энтальпии образования иона
водорода в растворе. Значения
H ионов также приведены в справочной
литературе.
ионов также приведены в справочной
литературе.
Задача 3. Рассчитать тепловой эффект реакции нейтрализации 1 моль соляной кислоты гидроксидом калия в стандартных условиях.
{HCl} + {KOH} = {KCl} + {H2O}
{H+} + {ОH-} → {H2O},
H ,
кДж/моль 0 -230,19 –285,84 ;
,
кДж/моль 0 -230,19 –285,84 ;
ΔНо298 = -55,65кДж/моль
К процессам с участием органических веществ применимо 2-е следствие из закона Гесса: Тепловой эффект реакции равен сумме стандартных теплот сгорания исходных веществ с учетом стехиометрических коэффициентов за вычетом суммы стандартных теплот сгорания продуктов реакции с учетом стехиометрических коэффециентов.
Н =
= –
– .
.
Большое значение тепловые эффекты сгорания имеют для определения калорийности пищи и теплотворной способности горючих веществ. Теплотворная способность – это тепловой эффект сгорания 1 кг твердого и жидкого веществ или единицы объема газообазного.
В ряде случаев для определения теплового эффекта можно использовать как 1-е, так и 2-е следствия из закона Гесса.
