
- •Теоретические основы химии
- •Основные понятия и законы химии Атомно - молекулярное учение.
- •Закон сохранения массы веществ
- •Составление химических уравнений
- •Расчеты по химическим уравнениям
- •Закон постоянства состава
- •Закон кратных отношений
- •Закон объемных отношений
- •Закон Авогадро и молярный объем газа
- •Следствия.
- •Закон эквивалентов
- •Основные классы неорганических
- •2. Разложение некоторых кислородсодержащих веществ (оснований, кислот, солей) при нагревании:
- •Основания
- •Получение оснований
- •Химические свойства оснований
- •Кислоты
- •Классификация кислот
- •Химические свойства кислот
- •Получение кислот
- •Средние соли
- •Химические свойства солей
- •Кислые соли
- •Графическое изображение формул
- •Энергетика химических реакций
- •Химическое равновесие. Константа химического равновесия
- •Энтропия
- •Энергия Гиббса направленность химических процессов
- •Примеры термодинамических расчетов
- •Полученные значения h и s характеризуют процесс испарения SnBr2. Процесс эндотермический, испарение требует нагревания. При испарении энтропия увеличивается.
- •Химическая кинетика. Скорость химической реакции
- •Молекулярность элементарных реакций
- •Уравнение Аррениуса
- •Катализ
- •Смещение химического равновесия
- •3 Влияние температуры на положение равновесия
- •Фазовые равновесия
- •Основные характеристики растворов
- •Растворимость газов в газах
- •Растворимость газов в жидкостях
- •Взаимная растворимость жидкостей
- •Растворимость твердых веществ в жидкостях
- •Растворы неэлектролитов
- •1. Давление насыщенного пара разбавленных растворов
- •2. Давление пара идеальных и реальных растворов
- •3. Температура кристаллизации разбавленных растворов
- •4. Температура кипения разбавленных растворов
- •5. Осмотическое давление разбавленных растворов
- •6. Понятие активности растворенного вещества
- •Слабые электролиты. Константа диссоциации
- •Сильные электролиты
- •PН растворов
- •Произведение растворимости
- •Гидролиз солей
- •Количественные характеристики процесса гидролиза соли.
- •Комплексные соединения
- •Направленность реакций в растворах электролитов
- •Протонная теория Брёнстеда-Лоури
- •В случае взаимодействия нейтральных молекулпродукт реакции (например bf3∙nh3) часто называют аддуктом.
- •Теория сольвосистем
- •Металлы, как типичные восстановители, окисляются до соединений, содержащих атомы металлов в более высоких степенях окисления, в зависимости от природы металла и характера среды:
- •Электродные потенциалы
- •Гальванические элементы
- •Электролиз
- •Законы электролиза
- •Примеры электролиза Расплавы
- •Растворы
- •Хими́ческие исто́чники то́ка
- •Коррозия металлов и методы защиты металлов от коррозии
- •Электрохимическая коррозия
- •Защита металлов от коррозии
- •Строение атома
- •Волновое уравнение. Квантовомеханическое объяснение строения атома
- •Электронная структура атомов и периодическая система элементов
- •Структура периодической системы элементов д.И. Менделеева.
- •Периодичность свойств химических элементов и их соединений
- •Ковалентная связь. Метод валентных связей
- •Способы образования ковалентной связи
- •Гибридизация атомных орбиталей
- •Метод молекулярных орбиталей
- •Ионная связь
- •Водородная связь
- •Квантовомеханические теории строения комплексных соединений
- •1. Теория валентных связей
- •2. Гибридизация орбиталей и структура комплексов
- •3. Теория кристаллического поля.
- •4. Цветность комплексных соединений
Направленность реакций в растворах электролитов
В растворах электролитовреакции всегда идут в сторону образования наименее диссоциированных или наименее растворимых веществ. Из этого, в частности, следует, что сильные кислоты вытесняют слабые из растворов их солей:
CH3COONa + HCl = CH3COOH + NaCl
Суть этой реакции более точно отражается ионно-молекулярным уравнением, где формулы слабых электролитовзаписаны в виде молекул, асильных– в виде ионов:
CH3COO– + Na+ + H+ + Cl– = CH3COOH + Na+ + Cl–
или в сокращенном виде:
CH3COO– + H+ = CH3COOH
Сокращенное ионное уравнение отражает самую суть происходящего процесса. Вступают в реакцию или образуются в ней в действительности только те частицы (ионы или молекулы), которые записаны в сокращенном уравнении. Аналогично протекают реакции между сильными основаниями и солями слабых оснований. Например:
FeSO4 + 2 NaOH = Na2SO4 + Fe(OH)2
Fe2+ + SO42– + 2 Na+ + 2 OH– = SO42– + 2 Na+ + Fe(OH)2
Fe2+ + 2 OH– = Fe(OH)2
При составлении ионно-молекулярных уравнений необходимо помнить:
в ионном виде записываются только хорошо растворимые сильные электролиты: растворимые соли, сильные кислоты ,основания, образованные щелочными и щелочноземельными металлами, поскольку в растворе такие соединения присутствуют только в виде ионов;
малорастворимые вещества, слабые электролиты и неэлектролиты записываются в виде молекул, поскольку концентрация ионов, образующихся за счет их диссоциации, в растворе очень мала, основная форма существования соединений молекулы.
Таким образом, при написании ионно-молекулярных уравнений необходимо знать растворимость и силу электролитов.
Zn(OH)2 + 2HCl = ZnCl2 + 2H2O
Zn(OH)2 + 2H+ + 2Cl–= Zn+2 + 2Cl– + 2H2O
или уравнение в сокращенном виде
Zn(OH)2 + 2H+ = Zn2+ + 2H2O
NH4Cl + H2O = NH4OH + HCl
NH + Cl–
+ H2O
= NH4OH
+ H+
+ Cl–
+ Cl–
+ H2O
= NH4OH
+ H+
+ Cl–
или уравнение в сокращенном виде
NH + H2O
= NH4OH
+ H+
+ H2O
= NH4OH
+ H+
AgCl + 2NH3 = [Ag(NH3)2]Cl
AgCl + 2NH3 = [Ag(NH3)2]+ + Cl–
[Ag(NH3)2]Cl + 2KCN = Ag(CN)2] + KCl + 2NH3
Реакции с участием малорастворимых веществ в молекулярной и ионно-молекулярной форме:
AgNO3 + KCl = AgCl + KNO3
уравнение в сокращенном виде:
Ag+ + Cl– = AgCl
СаСО3 + 2НCl = СаСl2 + СО2 + Н2О
СаСО3 + 2Н+ + 2Cl– = Са2+ + 2Сl– + СО2 + Н2О,
уравнение в сокращенном виде
СаСО3 + 2Н+ + = Са2+ + СО2 + Н2О.
Большинство процессов в растворах электролитов обратимы. Равновесие всегда смещено в сторону образования более устойчивых форм, то есть более слабых электролитов или наименее растворимых веществ, более устойчивых комплексных ионов.
Для решения вопроса о глубине и направленности процессов в общем случае нужно рассчитывать изменение энергии Гиббса.
Судить о направленности реакций в растворах электролитов можно также по другим термодинамическим характеристикам: константам равновесия процессов диссоциации слабых электролитов, константам равновесия распада или образования комплексных соединений, ПР малорастворимых электролитов.
Так, процесс нейтрализации сильной кислоты сильным основанием, записанный в виде молекулярного уравнения
HCl + NaOH = NaCl + H2O,
или ионно-молекулярного
Н+ + ОН– = H2O ,
характеризуется изменением энергии Гиббса, которое можно рассчитать по уравнению
 =
–RTlnKс= –RTln
=
–RTlnKс= –RTln ,
,
если
Т
= 298 К, а СН
СОН
СОН =
=
 =
10–14,
то для стандартных условий получим
=
10–14,
то для стандартных условий получим
 =
–8,314 298 2,303lg1014
= –8,314298
2,303 14 = –79,88 кДж.
=
–8,314 298 2,303lg1014
= –8,314298
2,303 14 = –79,88 кДж.
Значение изменения энергии Гиббса свидетельствует о большой термодинамической вероятности процесса.
Процесс
взаимодействия соли слабой кислоты с
более сильной кислотой с образованием
слабой кислоты также характеризуется
отрицательной величиной ,
и поэтому термодинамически возможен,
что подтверждается следующим расчетом:
,
и поэтому термодинамически возможен,
что подтверждается следующим расчетом:
NaClO + H2SO4 = Na2SO4 + 2HClO
ClO– + H+ = HClO
 =
–8,314 298 2,303 lg
=
–8,314 298 2,303 lg ;
; =
= =
=
 =
–8,314 298 2,303 7 = –39,940 кДж.
=
–8,314 298 2,303 7 = –39,940 кДж.
Результат термодинамического расчета хорошо согласуется с известным правилом: более сильная кислота вытесняет слабую из растворов её солей.
Рассмотрим процесс нейтрализации слабой кислоты щелочью при стандартных условиях:
HClO + NaOН = NaCl + H2O.
Запишем процесс в ионно-молекулярной форме, по которой удобно проводить расчет:
HClO + OН– = ClO– + H2O.
Изменение
энергии Гиббса
 можно рассчитать по уравнению
можно рассчитать по уравнению
 =
–8,314 298 2,303 lg
=
–8,314 298 2,303 lg
Если
умножить числитель и знаменатель дроби
на СН (чтобы получить в знаменателе
(чтобы получить в знаменателе
 –
ионное произведение воды), то уравнение
будет иметь вид:
–
ионное произведение воды), то уравнение
будет иметь вид:
 =
– 8,314298 2,303lg
=
– 8,314298 2,303lg
 =
=
 =
= = 107
= 107
и
тогда
 = –8,314298
2,303lg107
= –39,94 кДж.
= –8,314298
2,303lg107
= –39,94 кДж.
 0,
следовательно, процесс термодинамически
возможен, равновесие смещено в сторону
более слабого электролита
воды.
0,
следовательно, процесс термодинамически
возможен, равновесие смещено в сторону
более слабого электролита
воды.
В растворе возможна перестройка комплексных соединений с заменой лигандов при сохранении иона-комплексообразователя. В качестве примера рассмотрим процесс:
[Ag(NH3)2]NO3 + 2KCl = K[AgCl2] + 2NH3
[Ag(NH3)2]+ + 2С1– = [AgCl2]– +2NH3
К= .
.
Учитывая,
что Кнест.[AgCl ]
] =
= = 1,76 10–5,
а Кнест.
= 1,76 10–5,
а Кнест. =
= =9,3 10–8,
легко показать, что
=9,3 10–8,
легко показать, что
К=
 =
= ,
,
и
тогда
 = –8,314 298 2,303lg
= –8,314 298 2,303lg .Расчет дает величину
.Расчет дает величину
 =
–2988,3142,303lg
=
–2988,3142,303lg ,откуда
,откуда
 =
–2988,3142,303lg
5,28410–3
= 12,990 кДж.
=
–2988,3142,303lg
5,28410–3
= 12,990 кДж.
 0,
следовательно, процесс в прямом
направлении термодинамически маловероятен,
перестройка хлоридного комплекса
вероятнее. Такой же вывод можно сделать,
не проводя расчета
0,
следовательно, процесс в прямом
направлении термодинамически маловероятен,
перестройка хлоридного комплекса
вероятнее. Такой же вывод можно сделать,
не проводя расчета
 (см. раздел 14), а просто, сравнив константы
нестойкости комплексных ионов, так как
они однотипны. Комплекс [Ag(NH3)2]+
более устойчив, имеет меньшее значение
константы нестойкости, является более
слабым электролитом, чем [AgCl2]–,
поэтому равновесие смещено в сторону
его образования.
(см. раздел 14), а просто, сравнив константы
нестойкости комплексных ионов, так как
они однотипны. Комплекс [Ag(NH3)2]+
более устойчив, имеет меньшее значение
константы нестойкости, является более
слабым электролитом, чем [AgCl2]–,
поэтому равновесие смещено в сторону
его образования.
Если в реакции участвуют малорастворимые электролиты, а также слабые электролиты, то непосредственно сравнивать величины ПР и Кдисс.. слабого электролита для решения вопроса о возможности осуществления процесса нельзя, следует проводить расчет констант равновесия суммарного процесса или расчет изменения энергии Гиббса.
Рассмотрим процесс растворения сульфида меди в соляной кислоте при стандартных условиях:
[CuS] + 2{HCl}ag = {CuCl2} + (H2S)ag,
уравнение в ионно-молекулярной форме записывается
[CuS] + 2{H+}ag = {Cu+2}ag + (H2S)ag
Сульфид
меди малорастворим, ПРCuS
= 3,2
10–38,
сероводород в воде диссоциирует как
слабая кислота. Кдисс.
H S
по первой ступени составляет 6,0
10–8.
Непосредственно сравнивать величину
ПРCuS
и Кдис.
H
S
по первой ступени составляет 6,0
10–8.
Непосредственно сравнивать величину
ПРCuS
и Кдис.
H S
нельзя, тем более что рассматривается
выделение газообразного H2S.
Для того чтобы определить принципиальную
возможность осуществления процесса,
следует провести его термодинамический
анализ. Для этого нужно рассчитать
S
нельзя, тем более что рассматривается
выделение газообразного H2S.
Для того чтобы определить принципиальную
возможность осуществления процесса,
следует провести его термодинамический
анализ. Для этого нужно рассчитать
 процесса, используя термодинамические
характеристики
процесса, используя термодинамические
характеристики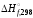 иS
иS всех частиц, участвующих во взаимодействии.
всех частиц, участвующих во взаимодействии.
[CuS] + 2{H+}ag = {Cu+2}ag + (H2S)
 ,
кДж/моль –53,1 0 66,99 –20,1
,
кДж/моль –53,1 0 66,99 –20,1
S ,
Дж/моль К 66,5 0 –92,8 205,6
,
Дж/моль К 66,5 0 –92,8 205,6
Изменение энтальпии в соответствии со следствием из закона Гесса рассчитывается по уравнению:
 =
=
 +
+ –
– – 2
– 2 = 66,99 –20,1 + 53,1 = 100 кДж.
= 66,99 –20,1 + 53,1 = 100 кДж.
Изменение
энтропии соответственно: S = S
= S +
S
+
S –
S
–
S –
S
–
S = –92,8 + 205,6 – 66,5= 46,3 Дж/моль К. Тогда
стандартное изменение энергии Гиббса:
= –92,8 + 205,6 – 66,5= 46,3 Дж/моль К. Тогда
стандартное изменение энергии Гиббса:
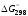 =
=
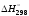 –ТS
–ТS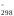 = 100000 – 46,3
298 = 86203 Дж.
= 100000 – 46,3
298 = 86203 Дж.
Рассчитанное изменение энергии Гиббса для процесса в прямом направлении свидетельствует о термодинамической невозможности растворения CuS в соляной кислоте. Правильность вывода, сделанного на основании термодинамического расчета, подтверждается экспериментальными данными, сульфид меди в соляной кислоте не растворяется.
ТЕОРИИ КИСЛОТ И ОСНОВАНИЙ
Единой теории кислотно-основного взаимод. и, следовательно, понятий кислотиоснованийпока нет. В настоящее время наиболее широко используются четыре теориикислотиоснований: Аррениуса, протонная, электронная и теория сольвосистем.
Теория Аррениуса
Согласно теории Аррениуса (рассматриваемой в школьном курсе), кислоты - это вещества, при электролитической диссоциации в водном растворе образующие катионы водорода Н+ и анионы кислотного остатка. Основания — это вещества, в водном растворе подвергающиеся электролитической диссоциации с образованием катионов металла и гидроксид-анионов ОН-
