
- •Теоретические основы химии
- •Основные понятия и законы химии Атомно - молекулярное учение.
- •Закон сохранения массы веществ
- •Составление химических уравнений
- •Расчеты по химическим уравнениям
- •Закон постоянства состава
- •Закон кратных отношений
- •Закон объемных отношений
- •Закон Авогадро и молярный объем газа
- •Следствия.
- •Закон эквивалентов
- •Основные классы неорганических
- •2. Разложение некоторых кислородсодержащих веществ (оснований, кислот, солей) при нагревании:
- •Основания
- •Получение оснований
- •Химические свойства оснований
- •Кислоты
- •Классификация кислот
- •Химические свойства кислот
- •Получение кислот
- •Средние соли
- •Химические свойства солей
- •Кислые соли
- •Графическое изображение формул
- •Энергетика химических реакций
- •Химическое равновесие. Константа химического равновесия
- •Энтропия
- •Энергия Гиббса направленность химических процессов
- •Примеры термодинамических расчетов
- •Полученные значения h и s характеризуют процесс испарения SnBr2. Процесс эндотермический, испарение требует нагревания. При испарении энтропия увеличивается.
- •Химическая кинетика. Скорость химической реакции
- •Молекулярность элементарных реакций
- •Уравнение Аррениуса
- •Катализ
- •Смещение химического равновесия
- •3 Влияние температуры на положение равновесия
- •Фазовые равновесия
- •Основные характеристики растворов
- •Растворимость газов в газах
- •Растворимость газов в жидкостях
- •Взаимная растворимость жидкостей
- •Растворимость твердых веществ в жидкостях
- •Растворы неэлектролитов
- •1. Давление насыщенного пара разбавленных растворов
- •2. Давление пара идеальных и реальных растворов
- •3. Температура кристаллизации разбавленных растворов
- •4. Температура кипения разбавленных растворов
- •5. Осмотическое давление разбавленных растворов
- •6. Понятие активности растворенного вещества
- •Слабые электролиты. Константа диссоциации
- •Сильные электролиты
- •PН растворов
- •Произведение растворимости
- •Гидролиз солей
- •Количественные характеристики процесса гидролиза соли.
- •Комплексные соединения
- •Направленность реакций в растворах электролитов
- •Протонная теория Брёнстеда-Лоури
- •В случае взаимодействия нейтральных молекулпродукт реакции (например bf3∙nh3) часто называют аддуктом.
- •Теория сольвосистем
- •Металлы, как типичные восстановители, окисляются до соединений, содержащих атомы металлов в более высоких степенях окисления, в зависимости от природы металла и характера среды:
- •Электродные потенциалы
- •Гальванические элементы
- •Электролиз
- •Законы электролиза
- •Примеры электролиза Расплавы
- •Растворы
- •Хими́ческие исто́чники то́ка
- •Коррозия металлов и методы защиты металлов от коррозии
- •Электрохимическая коррозия
- •Защита металлов от коррозии
- •Строение атома
- •Волновое уравнение. Квантовомеханическое объяснение строения атома
- •Электронная структура атомов и периодическая система элементов
- •Структура периодической системы элементов д.И. Менделеева.
- •Периодичность свойств химических элементов и их соединений
- •Ковалентная связь. Метод валентных связей
- •Способы образования ковалентной связи
- •Гибридизация атомных орбиталей
- •Метод молекулярных орбиталей
- •Ионная связь
- •Водородная связь
- •Квантовомеханические теории строения комплексных соединений
- •1. Теория валентных связей
- •2. Гибридизация орбиталей и структура комплексов
- •3. Теория кристаллического поля.
- •4. Цветность комплексных соединений
Энтропия
Возможность
самопроизвольного протекания химического
процесса определяется двумя факторами:
стремлением системы к понижению
внутренней энергии за счет экзотермической
реакции (-H )
и стремлением системы к увеличению
неупорядоченности в расположении частиц
за счет теплового движения. При
низких температурах преобладает
стремление к минимуму энергии. При
высоких температурах за счет усиления
хаотического движения частиц вещества
главную роль начинает играть фактор
повышения неупорядоченности,
мерой которой является функция состояния,
называемая энтропией.
)
и стремлением системы к увеличению
неупорядоченности в расположении частиц
за счет теплового движения. При
низких температурах преобладает
стремление к минимуму энергии. При
высоких температурах за счет усиления
хаотического движения частиц вещества
главную роль начинает играть фактор
повышения неупорядоченности,
мерой которой является функция состояния,
называемая энтропией.
Энтропия (S) - термодинамическая функция, однозначно характеризующая состояние системы независимо от ее предыстории. Она является количественной мерой неупорядоченности системы, мерой хаотического движения и взаимного расположения частиц. Энтропия зависит от природы вещества, его количества (концентрации), давления и температуры. В отличие от внутренней энергии и энтальпии можно определить абсолютное значение энтропии.
В изолированных системах (где обмен с окружающей средой энергией и массой невозможен) процессы самопроизвольно протекают лишь в сторону повышения энтропии (второе начало термодинамики). Т.е. в изолированных системах изменение энтропии может использоваться для определения направления самопроизвольного протекания процесса.
Энтропия вещества в определенном состоянии (при заданных параметрах) в определенном агрегатном состоянии (газ, жидкость, твердое) пропорциональна логарифму термодинамической вероятности нахождения вещества в этом состоянии (уравнение Больцмана):
S = k ln W,
Где k = R / NA , W – термодинамическая вероятность состояния, которая определяется числом микросостояний, с помощью которых может быть реализовано данное макросостояние.
В идеальном кристалле при абсолютном нуле Т=0К, движение прекращается, положение частиц остается неизменным, и вероятность состояния системы может быть только одна. Следовательно, энтропия идеального кристалла при абсолютном нуле S=0.
Третье начало термодинамики гласит, что энтропия беспримесного идеального кристаллического тела при температуре 0 К равна нулю.
Стандартной считается энтропия, отнесенная к 1 молю вещества при стандартных условиях (давление 1 атм (101,32 кПа) и температура 298 К (25 ОС)). Значения стандартных энтропий для большинства химических соединений представлены в справочной литературе. Единицей измерения энтропии, как правило, является Джоуль на моль-кельвин (Дж /( моль К)).
Зависимость энтропии от температуры связана с теплоемкостью изобарного (р = const и Δр = О) процесса (ΔСр ) и определяется (если считать теплоемкость величиной, не зависящей от температуры) следующим уравнением:
![]()
Поскольку
S0
незначительно зависит от температуры,
то S
S
S .
.
Оценить знак изменения энтропии в различных процессах можно, даже не проводя расчетов, а основываясь лишь на логических размышлениях.
Так, при подводе тепла неупорядоченность в расположении отдельных структурных единиц системы увеличивается, и энтропия растет. Степень увеличения неупорядоченности системы и рост ее энтропии зависят от количества подведенной теплоты и температуры. В ходе превращения твердого вещества в жидкое, а затем в газообразное, неупорядоченность системы, а следовательно, и энтропия увеличиваются ( ΔS> О ), так как возможности поступательного, колебательного, вращательного движения в системе существенно возрастают. Процессы испарения, плавления, расширения газа, разрыва связей между атомами сопровождаются увеличением энтропии. Процессы, сопровождающиеся увеличением упорядоченности системы: конденсация, кристаллизация, сжатие, упрочнение связей, полимеризация и т. п. приводят к уменьшению энтропии.
Для
различных процессов изменение стандартной
энтропии (S )
рассчитывают по формуле:
)
рассчитывают по формуле:
S =
=
 –
– .
.
Обозначения:
S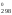 (S
(S )
– изменение стандартной энтропии
реакции.
)
– изменение стандартной энтропии
реакции.
S – стандартная энтропия вещества или
иона.
– стандартная энтропия вещества или
иона.
S – стандартная энтропия вещества или
иона при температуре, отличной от 298К.
– стандартная энтропия вещества или
иона при температуре, отличной от 298К.
Размерность
S – Дж/(К моль); S
– Дж/(К моль); S – Дж/К.
– Дж/К.
Так
как энтропия растет с повышением
температуры, то можно считать, что мера
беспорядка определяется произведением
Т
S (энтропийный
фактор)
(энтропийный
фактор)
Поскольку S0 незначительно зависит от температуры, то
Т
S
Т
S
Т
S .
.
