
- •Теоретические основы химии
- •Основные понятия и законы химии Атомно - молекулярное учение.
- •Закон сохранения массы веществ
- •Составление химических уравнений
- •Расчеты по химическим уравнениям
- •Закон постоянства состава
- •Закон кратных отношений
- •Закон объемных отношений
- •Закон Авогадро и молярный объем газа
- •Следствия.
- •Закон эквивалентов
- •Основные классы неорганических
- •2. Разложение некоторых кислородсодержащих веществ (оснований, кислот, солей) при нагревании:
- •Основания
- •Получение оснований
- •Химические свойства оснований
- •Кислоты
- •Классификация кислот
- •Химические свойства кислот
- •Получение кислот
- •Средние соли
- •Химические свойства солей
- •Кислые соли
- •Графическое изображение формул
- •Энергетика химических реакций
- •Химическое равновесие. Константа химического равновесия
- •Энтропия
- •Энергия Гиббса направленность химических процессов
- •Примеры термодинамических расчетов
- •Полученные значения h и s характеризуют процесс испарения SnBr2. Процесс эндотермический, испарение требует нагревания. При испарении энтропия увеличивается.
- •Химическая кинетика. Скорость химической реакции
- •Молекулярность элементарных реакций
- •Уравнение Аррениуса
- •Катализ
- •Смещение химического равновесия
- •3 Влияние температуры на положение равновесия
- •Фазовые равновесия
- •Основные характеристики растворов
- •Растворимость газов в газах
- •Растворимость газов в жидкостях
- •Взаимная растворимость жидкостей
- •Растворимость твердых веществ в жидкостях
- •Растворы неэлектролитов
- •1. Давление насыщенного пара разбавленных растворов
- •2. Давление пара идеальных и реальных растворов
- •3. Температура кристаллизации разбавленных растворов
- •4. Температура кипения разбавленных растворов
- •5. Осмотическое давление разбавленных растворов
- •6. Понятие активности растворенного вещества
- •Слабые электролиты. Константа диссоциации
- •Сильные электролиты
- •PН растворов
- •Произведение растворимости
- •Гидролиз солей
- •Количественные характеристики процесса гидролиза соли.
- •Комплексные соединения
- •Направленность реакций в растворах электролитов
- •Протонная теория Брёнстеда-Лоури
- •В случае взаимодействия нейтральных молекулпродукт реакции (например bf3∙nh3) часто называют аддуктом.
- •Теория сольвосистем
- •Металлы, как типичные восстановители, окисляются до соединений, содержащих атомы металлов в более высоких степенях окисления, в зависимости от природы металла и характера среды:
- •Электродные потенциалы
- •Гальванические элементы
- •Электролиз
- •Законы электролиза
- •Примеры электролиза Расплавы
- •Растворы
- •Хими́ческие исто́чники то́ка
- •Коррозия металлов и методы защиты металлов от коррозии
- •Электрохимическая коррозия
- •Защита металлов от коррозии
- •Строение атома
- •Волновое уравнение. Квантовомеханическое объяснение строения атома
- •Электронная структура атомов и периодическая система элементов
- •Структура периодической системы элементов д.И. Менделеева.
- •Периодичность свойств химических элементов и их соединений
- •Ковалентная связь. Метод валентных связей
- •Способы образования ковалентной связи
- •Гибридизация атомных орбиталей
- •Метод молекулярных орбиталей
- •Ионная связь
- •Водородная связь
- •Квантовомеханические теории строения комплексных соединений
- •1. Теория валентных связей
- •2. Гибридизация орбиталей и структура комплексов
- •3. Теория кристаллического поля.
- •4. Цветность комплексных соединений
Гидролиз солей
Обменное взаимодействие соли с водой, приводящее к образованию слабого электролита, называется гидролизом солей. Суть гидролиза солейзаключается в том, что происходит смещение равновесиядиссоциации водывследствие связывания одного из ее ионов с образованием малодиссоциированного или труднорастворимого продукта. Гидролиз идет по-разному в зависимости от силы кислоты и основания, образовавших соль.
Гидролизу подвергаются растворимые соли, образованные:
а) слабой кислотой и сильным основанием;
б) слабым основанием и сильной кислотой;
в) слабым основанием и слабой кислотой.
В гидролизе участвуют катионы слабого основания и анионы слабой кислоты, в большинстве случаев гидролиз – процесс обратимый, протекает ступенчато. Гидролиз приводит к изменению рН среды.
Уравнения реакций гидролиза составляют в молекулярной и ионно-молекулярной формах.
Соли, образованные слабым основанием и сильной кислотой, и соли, образованные слабой кислотой и сильным основанием, в обычных условиях подвергаются гидролизу в незначительной степени. Вторая и последующие ступени, если они возможны, почти не протекают, поэтому при рассмотрении процесса гидролиза, выше названных солей ограничиваются первой ступенью.
Например, гидролиз соли Na2CO3в растворе:
|
Na2CO3 |
NaOH– сильное основание H2CO3– слабая кислота |
Na+
+ CO |
гидролизу подвергается анион слабой кислоты:
CO +H2O
+H2O![]() HCO
HCO + ОН-(Іступень);
+ ОН-(Іступень);
в молекулярной форме:
Na2CO3+H2ONaНCO3+NaОН;
в растворе соли избыток ионов ОН-, среда щелочная, рН7.
Гидролиз соли ZnSO4в растворе:
|
ZnSO4 |
Zn(OH)2– слабое основание H2SO4– сильная кислота |
Zn2+
+ SO |
гидролизу подвергается катион слабого основания:
Zn2++H2O![]() ZnОН++ Н+(Іступень);
ZnОН++ Н+(Іступень);
в молекулярной форме:
2ZnSO4+ 2H2O![]() (ZnОН)2SO4+H2SO4;
(ZnОН)2SO4+H2SO4;
в растворе соли избыток ионов Н+, среда кислая, рН7.
Гидролиз соли, образованной слабым основанием и слабой кислотой, протекает, как правило, до конца; в результате образуются слабое основание и слабая кислота:
|
Al2S3 |
Al(OH)3– слабое основание H2S– слабая кислота |
2Al3+ + 3S2- |
Гидролизу подвергаются катионы слабого основания и анионы слабой кислоты:
 (Іступень)
(Іступень)
Образующиеся ионы Н+ и ОН- нейтрализуют друг друга, что вызывает смещение равновесия в сторону усиления гидролиза. Вследствие этого становится возможным протекание следующих ступеней гидролиза:
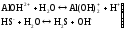 (II
ступень)
(II
ступень)
По указанной выше причине протекет и третья ступень гидролиза:
Al(OH) +H2O
= Al(OH)3
+ Н+
(III
ступень).
+H2O
= Al(OH)3
+ Н+
(III
ступень).
Суммарное ионно-молекулярное уравнение имеет вид:
2Al3+ + 3S2- + 6H2O = 2Al(OH)3 + H2S
или в молекулярном виде: Al2S3 + 6H2O = 2Al(OH)3 + 3H2S.
Таким образом, сульфид алюминия гидролизуется в растворе полностью и необратимо с образованием нерастворимого гидроксида Al(OH)3 и слабой кислоты H2S. рН раствора близок к 7. Характер среды (слабокислая или слабощелочная) определяется константой диссоциации слабого основания или слабой кислоты по первой ступени.
При сливании водных растворов двух солей, имеющих разную природу, т.е. одна образована слабой кислотой и сильным основанием, а другая – слабым основанием и сильной кислотой, происходит совместный гидролиз этих солей. Одна соль гидролизует по аниону, а другая – по катиону. Образующиеся в результате гидролиза ионы ОН- и Н+ нейтрализуют друг друга, и равновесие каждой из ступеней гидролиза смещается вправо, т.е. гидролиз усиливается и в некоторых случаях идет до конца, например:
Al2(SO4)3 + 3Na2SO3 + 6H2O = 2Al(OH)3 + 3Н2SO3 + 3Na2SO4;
в ионно-молекулярной форме уравнение гидролиза имеет вид:
2Al3+
+ 3SО + 6H2O
= 2Al(OH)3
+ 3Н2SО3.
+ 6H2O
= 2Al(OH)3
+ 3Н2SО3.


