
Malashonok_Neorganicheskaya_khimia_2014
.pdfных условиях неустойчивы. Получаемая при разложении кислотами сплавов бора с магнием газовая смесь на воздухе самовоспламеняется:
2В4Н10 + 11О2 = 4В2О3 + 10Н2О.
Горение боранов сопровождается выделением огромного количества тепла (у В2Н6 выделяется 2025 кДж/моль, а у С2Н6 – всего 1425 кДж/моль), что создает возможность их эффективного использования как реактивного топлива.
Большинство боранов разлагаются водой: В2Н6 + 6Н2О = 2Н3ВО3 + 6Н2 .
Изолированный от воздуха и воды B2H6 может сохраняться почти без разложения месяцами.
Из производных диборана (В2Н6) наиболее важны аналогичные фтороборатам по строению тетрагидридобораты М[BH4] (боргидриды, или боронаты), известные для ряда металлов. Примером может служить бесцветный кристаллический NaBH4, устойчивый при обычных условиях и хорошо растворимый в воде. Водород в анионе [BH4] отрицателен аналогично атомам галогенов.
Взаимодействие диборана с порошком гидрида лития в кипящем эфире ведет к образованию тетрагидридобората лития:
2LiH + В2Н6 = 2Li[ВН4].
Тетрагидридобораты щелочных металлов имеют характер типичных солей. Они хорошо растворимы в воде, взаимодействуя с ней:
MеBH4 + 4H2O = 4H2 + MеOH + H3BO3.
Скорость гидролиза уменьшается в ряду Li >> Na > K, причем боргидриды Na и K разлагаются холодной водой очень медленно. Горячая вода разлагает рассматриваемые тетрагидридобораты быстрее, а в кислой среде разложение их идет очень быстро. Параллельно с гидролизом под действием кислот может частично протекать и реакция типа:
2MеBH4 + 2HСl = 2MеСl + H2 + B2H6.
Боргидриды щелочных металлов обладают сильно выраженными восстановительными свойствами. На практике чаще используется NaBH4. С его помощью, например, удобно получать летучие гидриды Ge, Sn, As и Sb из их хлоридов. Из LiBH4 можно получить большое количество водорода. Широкое использование находят тетрагидридобораты в органической химии как восстановители альдегидов и кетонов до соответствующих спиртов.
181
Получение боранов. С водородом бор непосредственно не реагирует. Гидриды бора получают косвенным путем. Получить диборан можно восстановлением соединений бора водородом:
2BCl3 + 6H2 t В2Н6 + 6HCl (t = 450°С, катализатор Cu–Al).
Восстановлением галогенидов бора гидридами:
2BF3 + 6LiH t В2Н6 + 6LiF (t = 35°С, эфир).
Бороводороды являются нервными ядами. В организм они могут попадать не только через дыхательную систему, но и путем всасывания кожей. Острое отравление может вызвать головную боль, тошноту, слабость, судороги, состояние сильного раздражения или, наоборот, психической депрессии. При хроническом отравлении страдают главным образом органы дыхания, печень и почки. При случайном попадании борана на кожу ее следует тотчас же протереть разбавленным раствором аммиака.
Кислородсодержащие соединения бора
Оксид бора B2O3 (ангидрид борной кислоты), как и оксид кремния, существует в виде полимера. Это бесцветное, довольно тугоплавкое стекловидное или кристаллическое вещество горьковатого вкуса, диэлектрик.
Стеклообразный оксид бора имеет слоистую структуру (sp2-гиб- ридизация орбиталей атомов бора), в слоях атомы бора расположены внутри равносторонних треугольников ВО3. Эта модификация плавится в интервале температур 325–450°C и обладает высокой твердостью. Она получается при нагревании бора на воздухе при 700°C или обезвоживанием ортоборной кислоты:
4В + 3О2 t 2В2О3; 2H3BO3 t В2О3 + 3Н2О.
Кристаллический В2О3 существует в двух модификациях – с гексагональной и моноклинной кристаллической решеткой, его получают осторожным отщеплением воды от метаборной кислоты НВО2.
Борный ангидрид гигроскопичен, бурно растворяется в воде, образуя вначале различные метаборные кислоты общей формулы (НВO2)n. Дальнейшее присоединение воды приводит к образованию ортоборной кислоты H3BO3.
182

В расплавленном состоянии B2O3 хорошо растворяет оксиды многих элементов, образуя соли:
В2О3 + CaO t Ca(BO2)2. B2O3 является кислотным оксидом:
В2О3 + 2NaOH t 2NaBO2 + Н2О. B2O3 проявляет очень слабые признаки амфотерности:
2В2О3 + 2P2О5 t 4ВPО4; В2О3 + 6HF t 2BF3 + 3Н2О.
Много общего имеет химия кислородных соединений бора и кремния: кислотная природа оксидов, способность образовывать многочисленные полимерные структуры, стеклообразование оксидов.
B2O3 является ангидридом ряда борных кислот, самой устойчивой из которых является ортоборная кислота.
Ортоборная кислота H3BO3 (борная кислота) – |
|
|
|
|
|
|
|
|
|
|
|
|
|
Н |
|
|
|
|
|
|
|
||||
слабая кислота. Бесцветное кристаллическое вещество |
|
|
|
|
|
О |
|
|
||||
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|||||
в виде чешуек без запаха, имеет слоистую решетку |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
В |
|
|
|
|
|
||
(sp2-гибридизация орбиталей атома бора), в которой мо- |
|
|
|
|
|
|
Н |
|||||
|
|
|
|
|
|
|
|
|
|
|||
О |
|
|
|
|
О |
|||||||
|
||||||||||||
лекулы H3BO3 соединены водородными связями в плос- |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
кие слои, слои соединены между собой межмолекуляр- |
Н |
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|||||
нымисвязями. |
|
|
|
|
|
|
|
|
|
|
|
|
Метаборная кислота (HBO2)n является полимерным соединением, представляет собой бесцветные кристаллы, которые в растворе легко гидратируются с образованием ортоборной кислоты.
При нагревании ортоборная кислота теряет воду и сначала переходит в метаборную кислоту, затем в тетраборную H2B4O7. При дальнейшем нагревании обезвоживается до борного ангидрида:
H3BO3 HBO2 + H2O; 4НВО2 Н2В4О7 + Н2О;
Н2В4О7 2В2О3 + Н2О.
В водном растворе все кислоты бора превращаются в H3BO3:
HBO2 + H2O = H3BO3.
H2B4O7 + 5H2O = 4H3BO3.
183
В отличие от обычных кислот, ортоборная кислота в водном растворе не отщепляет Н+, а вызывает смещение равновесия диссоциации воды, присоединяя за счет донорно-акцепторного взаимодействия OH–, выступает в роли одноосновной кислоты:
B(OH)3 + H2O B(OH) 4 + H+; Kдис = 5,8 · 10–10.
Ортоборная кислота наиболее устойчива, однако соли ее не существуют. Стабильными являются соли мета- и тетраборной кислот. Так, при действии на раствор ортоборной кислоты гидроксидом натрия образуется не ортоборат, а тетраборат натрия (при недостатке NaOH) или метаборат (в избытке NaOH):
2NaOH(нед) + 4H3BO3 = Na2B4O7 + 7H2O;
NaOH(изб) + H3BO3 = NaBO2 + 2H2O.
Мета- и тетрабораты гидролизуются (реакции, обратные приведенным), но в небольшой степени. Кислотный гидролиз тетрабората натрия приводит к образованию ортоборной кислоты:
Na2B4O7 + 2HCl + 5H2O = 2NaCl + 4H3BO3.
Тетраборат натрия в избытке щелочи превращается в метаборат натрия:
Na2B4O7 + 2NaOH(изб) = 4NaBO2 + H2O.
При нагревании борная кислота растворяет оксиды металлов, образуя соли. Со спиртами в присутствии концентрированной серной кислоты образует эфиры:
H3BO3 + 3CH3OH = 3H2O + B(OCH3)3.
Образование борнометилового эфира В(ОСН3)3 является качественной реакцией на Н3ВО3 и соли борных кислот, при поджигании борнометиловый эфир горит красивым ярко-зеленым пламенем.
Химия бороводородов и их производных по своему характеру и богатству синтетических возможностей приближается к органической химии. Нагревание H3N · BH3 в запаянной трубке до 270°С ведет к образованию триборинтриимина (боразола или боразина) – В3N3H6.
Боразол представляет собой бесцветное жидкое вещество
(tпл = 56°С, tкип = 55°С). Молекула В3N3H6 изоэлектронна молекуле бензола, имеет форму шестиугольника из поочередно расположенных
радикалов ВН и NH. Три атома азота поставляют свои неподеленные электронные пары на свободные орбитали атомов бора:
184
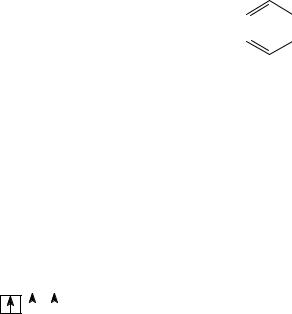
Так как триборинтриимин по строению и некото- |
|
Н |
||
рым физическим свойствам похож на бензол, его ино- |
|
N |
||
гда называют «неорганическим бензолом». Однако, в |
НB |
|
|
BН |
|
|
|||
отличие от бензола, молекула В3N3H6 не имеет плос- |
НN |
|
|
NН |
|
|
|||
кую структуру, имеет дипольный момент, обуслов- |
|
B |
||
ленный отклонением связей N H от плоскости ше- |
|
Н |
||
|
|
|
|
|
стиугольника. Боразол окисляется на воздухе, растворим в воде, с которой постепенно реагирует с образованием В(ОН)3, NH3 и Н2, и менее термически устойчив, чем бензол.
Алюминий
Электронно-графическая схема Al в возбужденном состоянии:
13Al: 3s13p2. |
3s 3 p |
|||||
|
|
|
|
|
|
|
В атоме алюминия на внешнем энергетическом уровне находятся три электрона. Разница в энергии между 3s- и 3p-подуровнями сравнительно мала. Поэтому в химических реакциях алюминий, как правило, проявляет степень окисления +3. За счет вакантных 3p- и 3d-орбиталей алюминий в соединениях может проявлять валентность
IV (Na[Al(OH)4]) и VI (Na3[Al(OH)6]).
Нахождение в природе. В природе алюминий встречается в виде оксидов и солей. Важнейшие минералы, содержащие Al: Al2O3 nH2O –
боксит, Al2O3 – корунд, Al2O3 2SiO2 2H2O – каолинит, Na3AlF6 – криолит, Na(K)2O Al2O3 2SiO2 – нефелин.
Физические свойства. Серебристо-белый пластичный металл, с высокой тепло- и электропроводностью, очень легкий (плотность 2,7 г/см3), но механически прочный, плавится при температуре 660°С.
Алюминий занимает первое место среди металлов и третье среди всех элементов по распространенности в земной коре, уступая только кислороду и кремнию.
Получение. Алюминий получают электролизом расплава Al2O3 в присутствии криолита Na3[AlF6], введение которого существенно снижает температуру плавления. Температура плавления чистого Аl2O3 равна 2072°С. Использование криолита позволяет проводить электролиз при сравнительно низкой температуре – менее 1000°С. Удобство использования криолита в качестве растворителя состоит в том, что он достаточно электропроводен.
185
Растворенныйвкриолитеоксидалюминиядиссоциирует:
Al2O3 AlO+ + AlO2 .
На электродах протекают следующие процессы:
Катод 2AlO+ + 3e– = Al + AlO2 ; Анод 2AlO 2 – 4e– = O2 + 2AlO+;
2Al O Электролиз 4Al + 3O .
2 3 2
Благодаря сравнительно низкой плотности расплава образующийся жидкий алюминий опускается на дно электролизера, чем облегчается выделение газов на аноде. Катодом служит выложенный графитовыми плитами корпус электролизера. На нем выделяется алюминий, на угольном аноде – кислород.
Криолита Na3AlF6 в природе содежится недостаточное количество, поэтому его готовят искусственно путем совместного растворения Al(OH)3 и соды в плавиковой кислоте HF:
3Na2CO3 + 2Al(OH)3 + 12HF = 2Na3AlF6 + 3CO2 + 9H2O.
Электролитическое производство алюминия включает стадию выделения чистого Аl2O3 из природного сырья. Непосредственно использовать боксит нельзя из-за большого количества примесей (SiO2, Fe2O3, СаО и др.). Для выделения чистого Аl2O3 боксит сначала обжигают, при этом удаляется содержащаяся в нем вода, затем его сплавляют с содой:
Аl2O3 + Na2CO3 t 2NaAlO2 + СO2.
Полученный сплав алюмината натрия растворяют в воде, при этом примеси Fe(ОН)3 и другие выпадают в осадок, который отделяют. Затем в раствор алюмината натрия пропускают СO2 и получают чистый Аl(ОН)3, при прокаливании которого образуется Аl2O3:
2NaAlO2 + СO2 + 3Н2O t 2Аl(ОН)3 + Na2CO3.
Химические свойства. Алюминий покрыт тонкой и прочной оксидной пленкой Al2O3 и поэтому не реагирует со многими окисли-
телями: O2, HNO3(конц) и H2SO4(конц) (без нагревания), с H2O. Однако при разрушении оксидной пленки алюминий выступает как активный
металл-восстановитель.
186
Характерные реакции |
Примеры реакций |
|
|||||
|
|
Спростымивеществами |
|
|
|
|
|
1. С фтором, хлором и бромом |
2Al + 3Сl2 2AlCl3 (хлорид) |
|
|||||
алюминий реагирует при обычных |
|
|
|
|
|
||
условиях |
|
|
|
|
|
|
|
2. При нагревании алюминий реа- |
|
t |
|
|
|
||
2Al + 3S Al2S3 (сульфид); |
|
||||||
гирует с серой, азотом, |
фосфо- |
|
|
t |
|
|
|
ром, углеродом с образованием |
2Al + N2 2AlN (нитрид); |
|
|||||
|
t |
|
|
|
|||
сульфидов, нитридов, фосфидов и |
Al + P AlP (фосфид); |
|
|||||
карбидов соответственно |
|
|
|
t |
|
|
|
|
4Al + 3C Al4C3 (карбид) |
|
|||||
|
|
Сосложнымивеществами |
|
|
|
|
|
1. Очищенный от оксидной плен- |
2Al + 6H2O = 2Al(OH)3 + 3H2↑ |
|
|||||
ки алюминий энергично реагирует |
|
|
|
|
|
||
с водой |
|
|
|
|
|
|
|
2. Концентрированная |
и |
сильно |
Al + 4HNO3(pазб) |
= Al(NO3)3 + NO↑ + 2H2O; |
|||
разбавленная HNO3, а также кон- |
Al + 6HNO3(конц) |
|
t |
|
|
||
Al(NO3)3 + 3NO2↑ + |
|||||||
центрированная H2SO4 на холоде |
|
+ 3H2O; |
|
||||
не взаимодействуют |
с |
Al. При |
8Al + 30HNO3(оч.разб) |
t |
+ |
||
нагревании эти кислоты с алюми- |
8Al(NO3)3 |
||||||
+ 3NH4NO3 |
+ 9H2O; |
|
|||||
нием взаимодействуют |
|
|
|
||||
|
|
|
|
|
t |
|
|
|
|
|
2Al + 6H2SO4(конц) Al2(SO4)3 + |
|
|||
|
|
|
+ 3SO2↑ + 6H2O |
|
|||
3. Алюминий хорошо растворяет- |
2Al + 6HCl = 2AlCl3 + 3H2↑ |
|
|||||
ся в кислотах-неокислителях |
|
|
|
|
|
||
4. Алюминий взаимодействует как |
|
|
|
t |
+ |
||
2Al + 2NaOH + 2H2O 2NaAlO2 |
|||||||
с расплавами, так и с водными |
|
|
+ 3H2↑; |
|
|||
растворами щелочей. При этом |
2Al + 6NaOH + 6H2O = 2Na3[Al(OH)6] + 3H2 |
||||||
выделяется водород |
|
|
|
|
|
|
|
5. Очищенный от оксидной плен- |
2Al + 3CuSO4 = Al2(SO4)3 + 3Сu |
|
|||||
ки алюминий вытесняет из водных |
|
|
|
|
|
||
растворов солей менее активные |
|
|
|
|
|
||
металлы |
|
|
|
|
|
|
|
6. Алюминий используют для по- |
2Al + Cr2O3 |
t |
|
|
|||
Al2O3 + 2Cr, |
|
||||||
лучения металлов из |
их |
оксидов |
Н298 |
= –498,8 кДж |
|
||
(алюмотермия) |
|
|
|
|
|
|
|
Алюминий образует карбиды состава: Al4C3 – метанид, Al2(C2)3 – ацетиленид. Ацетиленид можно получить по реакции:
2Al + 3C2H2 = Al2(C2)3 + 3H2.
Карбиды и нитриды – солеподобные кристаллические вещества, они разлагаются водой:
Al4C3 + 12H2O = 4Al(OH)3 + 3CH4;
метанид |
метан |
187
Al2(C2)3 + 6H2O = 2Al(OH)3 + 3C2H2;
ацетиленид ацетилен
AlN + 3H2O = Al(OH)3 + NH3.
Нитрид алюминия, кроме реакции взаимодействия простых веществ, может быть получен при пропускании через алюминий аммиака:
2Al + 2NH3 t 2AlN + 3H2.
AlN находит применение в электронике вместо глинозема и оксида бериллия.
Алюминий с водородом непосредственно не взаимодействует. Гидрид алюминия AlH3 получают косвенным путем. В нормальных условиях AlH3 – бесцветное или белое твердое вещество, имеющее полимерную структуру: (AlH3)n.
Соединениенестабильно, принагреваниивыше100°C разлагается: 2AlH3 t 2Al + 3H2 .
Гидрид алюминия разлагается водой:
AlH3 + 3H2O = Al(OH)3 + 3H2 .
AlH3 взаимодействует с основными гидридами в эфирном растворе с образованием гидридоалюминатов:
AlH3 + LiH = Li[AlH4].
Медленно вступает в реакцию с дибораном, образуя борогидрид алюминия:
2AlH3 + 3B2H6 = 2Al(BH4)3.
Al(BH4)3 – очень реакционноспособное вещество, перспективно в качестве ракетного топлива.
Оксид и гидроксид алюминия. Физические свойства. Al2O3 –
твердое тугоплавкое вещество; существует в нескольких кристаллических модификациях. Наиболее известен -Al2O3 (корунд): белое, тугоплавкое, химически инертное вещество. Химическая стойкость, термическая устойчивость Al2O3 объясняются прочностью связей Al–O, в образовании которых участвуют свободные d-орбитали атома алюминия и неподеленные электронные пары атома О (донорно-акцеп- торное взаимодействие).
Сильно прокаленный Al2O3 называется алундом, он используется при изготовлении тиглей и огнеупорных материалов.
188

Al(OH)3 – твердое вещество белого цвета, нерастворимое в воде. Формула Al(ОН)3 условна, точнее Al2О3 nН2О.
Химические свойства оксида и гидроксида алюминия
|
Реагенты. Характерные реакции |
Примеры реакций |
|
|
|
|
Оксид алюминия Al2O3 – амфотерный оксид |
|
|
с преобладанием основных свойств |
|
|
|
|
1. |
С водой не реагирует. |
Al2O3 + H2O ≠ |
2. |
С кислотами |
Al2O3 + 6HCl = 2AlCl3 + 3H2O |
3. C растворами щелочей |
Al2O3 + 6NaOH + 3H2O = 2Na3[Al(OH)6] |
|
4. |
Сплавляется со щелочами или кар- |
Al2O3 + 2NaOH t 2NaAlO2 + H2O; |
бонатами щелочных металлов |
Al2O3 + Na2CO3 t 2NaAlO2 + CO2 |
|
5. |
С основными оксидами |
Al2O3 + СаO t Сa(AlO2)2 |
6. Снекоторымикислотнымиоксидами |
Al2O3 + 3SO3 = Al2(SO4)3 |
|
ГидроксидалюминияAl(OH)3 – слабый электролит с амфотерными свойствами
1. |
С кислотами (как основание) |
Al(OH)3 + 3HCl = AlCl3 + 3H2O |
|
2. |
С растворами и расплавами щелочей |
Al(OH)3 + NaOH = Na[Al(OH)4]; |
|
(как кислота) |
Al(OH)3 + 3NaOH = Na3[Al(OH)6]; |
||
|
|
|
Al(OH)3 + NaOH t NaAlO2 + 2H2O |
3. Сплавляется с основными оксидами |
2Al(OH)3 + СaO t Сa(AlO2)2 + 3H2O |
||
4. |
Некоторыми кислотными оксидами |
2Al(OH)3 + 3SO3 = Al2(SO4)3 + 3H2O |
|
5. |
Термически неустойчив, теряет во- |
2Al(OH)3 t Al2O3 + 3H2O |
|
ду при нагревании 100°С |
|
||
Получение оксида алюминия:
4Al + 3O2 2Al2O3, Н298 = –3350 кДж; 2Al(OH)3 t Al2O3 + 3H2O.
Получение гидроксида алюминия:
AlCl3 + 3NaOH(нед) = Al(OH)3 + 3NaCl; Al2(SO4)3 + 6NH4OH = 2Al(OH)3 + 3(NH4)2SO4; Na[Al(OH)4] + CO2 = Al(OH)3 + NaНCO3; Al2S3 + 6H2O = 2Al(OH)3 + 3H2S.
Некоторые свойства солей алюминия. Алюминий образует со-
ли с большинством известных кислот. В парах и органических растворителях хлориды, бромиды и иодиды алюминия существуют в виде димеров с мостиковыми галогенами:
189

Cl |
Cl |
Cl |
|
Al |
Al |
Cl |
Cl |
Cl |
В галогенидах алюминия реализуется дативная связь. Соединения широко используют в органической химии в качестве катализаторов. Это легколетучие (кроме фторида) вещества (хлорид алюминия возгоняется уже при 180оС), бурно реагирующие с водой, поскольку заменяется окружение атома алюминия:
Al2Cl6 + 6H2O = 2[Al(H2O)6]Cl3.
Алюминаты под действием воды практически полностью разлагаются:
NaAlO2 + 2H2O = Al(OH)3 + NaOH.
Алюминаты также разлагаются кислотами. Состав продукта зависит от количественного соотношения между солью и кислотой:
Na[Al(OH)4] + HCl(нед) = Al(OH)3 + NaСl + H2O;
NaAlO2 + HCl(нед) + H2O = Al(OH)3 + NaСl;
Na[Al(OH)4] + 4HCl(изб) = AlCl3 + NaСl + 4H2O;
Na3[Al(OH)6] + 6HCl(изб) = AlCl3 + 3NaСl + 6H2O;
NaAlO2 + 4HCl(изб) = AlCl3 + NaСl + 2H2O.
Соли Al3+ выделяются из растворов в виде кристаллогидратов: AlCl3 6H2O, Al(NO3)3 9H2O. Сульфаты алюминия с сульфатами щелочных металлов образуют двойные соли – квасцы (KAl(SO4)2 12Н2О – алюмокалиевые квасцы), которые широко применяются для очистки воды, дубления кож, протравления тканей перед покраской.
Все соли Al3+растворимы, кроме AlPO4, AlF3. В водных растворах соли Al+3подвергаются гидролизу:
Al2(SO4)3 + 2H2O 2AlOHSO4 + H2SO4;
Al3+ + H2O AlOH2+ + H+.
Соли алюминия, образованные слабыми кислотами (сульфиды, сульфиты, карбонаты, цианиды), не могут быть выделены из водных растворов, так как полностью гидролизуются:
Al2(SO4)3 + 3Na2S + 6H2O = 2Al(OH)3 + 3H2S + 3Na2SO4.
190
