
Malashonok_Neorganicheskaya_khimia_2014
.pdf3Mg + N2 t Mg3N2; 2B + N2 t 2BN.
Поддействиемэлектрическогоразрядаазотреагируетскислородом:
O2 + N2 2NO.
С водородом при температуре около 500°С и давлении 10– 100 МПа в присутствии катализатора – металлического железа:
3H2 + N2 2NH3.
В промышленности чистый азот наряду с кислородом получают фракционной перегонкой жидкого воздуха. На первой стадии из воздуха удаляют частицы пыли, пары воды и углекислый газ. Затем воздух сжижают, охлаждая его и сжимая до высоких давлений. Далее фракционной перегонкой жидкого воздуха разделяют азот, кислород и аргон. Первым отгоняетсяазот(tкип = –195,79ºС), затемкислород(tкип = –182,95ºС).
Получение азота в лаборатории
Тип реакции |
Пример |
|
Разложение твердого нитрита аммония |
NH4NO2 t N2 + 2H2O |
|
Реакции окисления аммиака |
4NH3 + 3O2 = 2N2 + 6H2O; |
|
2NH3 + 3CuO = N2 + 3Cu + 3H2O |
||
|
||
Взаимодействие металлов с азотной |
12HNO3(разб) + 5Mg = N2 + 5Mg(NO3)2 + |
|
кислотой |
+ 6H2O |
|
Термическое разложение азида лития |
2LiN3 t 3N2 + 2Li |
Водородные соединения азота
Азот образует несколько водородных соединений – это гидразин N2H4 (степень окисления азота –2), гидроксиламин NH2OH (степень окисления азота –1) и важнейшее водородное соединение азота аммиак NH3 (степень окисления азота –3).
Аммиак NH3 – ковалентное соединение. Молекула аммиака имеет форму тригональной пирамиды. Согласно методу валентных связей валентные орбитали атома азота находятся в состоянии sp3-гибри- дизации, из четырех гибридных орбиталей три участвуют в образовании химических связей с атомами водорода, а четвертую занимает неподеленная пара электронов. Поэтому молекула аммиака полярна и имеет ярко выраженный донорный характер. Из-за отталкивания неподеленной пары электронов и электронных пар, образующих связи, угол в молекуле отличается от тетраэдрического и составляет 107° (рис. 3.3).
71

2p
2s
N
H1s H1s H1s
Рис. 3.3. Механизм образования связей и строение молекулы аммиака
Физические свойства NH3. Аммиак – бесцветный газ, с резким удушливым запахом, почти в два раза легче воздуха. Молекулы аммиака в конденсированном состоянии связаны между собой водородными связями (рис. 3.4):
НН
Н N |
_ |
+ |
N |
|
|||
|
Н |
НН
Рис. 3.4. Образование водородных связей между молекулами аммиака
Поэтому его температура кипения (–33°С) и температура плавления (–78°С) выше, чем у водородных соединений других элементов V группы. Вследствие образования водородных связей с молекулами воды (рис. 3.4) аммиак очень хорошо растворим в воде, в 1 объеме воды при 20°С растворяется 700 объемов аммиака. Раствор аммиака
вводе с массовой долей NН3 около 25%, называют аммиачной водой,
а10%-ный водный раствор в медицине называют нашатырным спиртом.
Впромышленности аммиак получают по обратимой реакции в присутствии катализатора (металлическое железо с примесью оксидов алюминия и калия), Р = 10–100 МПа, t = 400–600°С:
3H2 + N2 2NH3 , ∆Η° = –92,4 кДж.
Всоответствии с принципом Ле Шателье увеличение выхода аммиака должно происходить при повышении давления и понижении температуры. При низких температурах скорость реакции очень маленькая, поэтому процесс ведут при повышенных температурах.
Влаборатории NH3 получают действием щелочей на соли аммония либотермическимразложениеммалоустойчивыхсолейаммония:
72
NH4Cl + KOH = KCl + NH3 + H2O;
NH4НСО3 |
t |
|
NH3 + СО2 + H2O. |
||
Химические свойства аммиака |
||
|
|
|
Тип реакции |
Пример |
|
Восстановительные свойства |
4NH3 + 3O2 = 2N2 + 6H2O; |
|
с кислородом |
4NH3 + 5O2 4NO + 6H2O |
|
|
кат., to |
|
С оксидами малоактивных |
t o |
|
металлов при нагревании |
2NH3 + 3CuO N2 + 3Cu + 3H2O |
|
|
||
С водой при растворении об- |
NH3 + H2O NH3 · H2O NH 4 + OH- |
|
разуется водородная связь с |
|
|
молекулами воды, рН > 7 |
|
|
С кислотами |
NH3 + HCl = NH4Cl |
|
|
|
|
C солями для получения не- |
3NH3 + 3H2O + AlCl3 = Al(OH)3 + 3NH4Cl; |
|
Fe2(SO4)3 + 6NH3 + 6H2O = 2Fe(OH)3 + |
||
растворимых оснований |
||
|
+ 3(NH4)2SO4 |
|
|
|
|
С активными металлами |
2NH3 + 6Na = 2Na3N + 3H2 (нитрид натрия); |
|
|
||
|
NH3 + 2Na = Na2NH + H2 (имид натрия); |
|
|
2NH3 +2Na = 2NaNH2 + H2 (амид натрия) |
|
В реакциях комплексообразо- |
CuSO4 + 4NH3 = [Cu(NH3)4]SO4; |
|
вания, где NH3 является ли- |
||
Hg(NO3)2 + 4NH3 = [Hg(NH3)4](NO3)2 |
||
гандом – донором электронов |
||
C окислителями |
10NH3 + 6KMnO4 + 9H2SO4 = 5N2 + 6MnSO4 + |
|
+ 3K2SO4 + 24H2O; |
||
|
||
|
4NH3 + 3F2 = NF3 + 3NH4F; |
|
|
8NH3 + 3Cl2 = 6NH4Cl + N2; |
|
|
4NH3 + 3I2 = I3N ↓ + 3NH4I |
|
|
|
|
Соли аммония. Все соли аммония – кристаллические вещества, хорошо растворимые в воде. Ионы NH +4 подвергаются гидролизу, со-
здавая, кислую среду:
NH 4 + H2O NH3 · H2O + H+.
В солях аммония катион NH 4 содержит азот в степени окисления
–3. При нагревании все соли аммония разлагаются. Если аммонийная соль образована кислотой, не проявляющей окислительные свойства, при нагревании образуется аммиак:
73

NH4Cl t NH3 + HCl.
Если же аммонийная соль образована кислотой-окислителем, при нагревании происходит внутримолекулярное окислительно-восста- новительное разложение:
NH4NO2 t N2 + 2H2O; NH4NO3 t N2O + 2H2O; (NH4)2Cr2O7 t Cr2O3 + N2 + 4H2O.
На восстановительном свойстве N–3 основано применение NH3 и его солей в процессе пайки металлов – снятие оксидной пленки с поверхности:
3CuO + 2NH4Cl t 3Cu + N2 + 2HCl + 3H2O.
Жидкий аммиак является сильно ионизирующим растворителем. Собственная ионизация NH3 меньше, чем воды:
NH3 + NH3 NH 4 + NH 2 , Ks =10–33;
H2O + H2O H3O+ + OH–, Ks =1,8 10–16,
где Ks – константа автопротолиза растворителя (ионное произведение растворителя).
При этом в жидком аммиаке производные иона NH 4 , напри-
мер, NH4Cl, ведут себя как сильные кислоты, а производные иона NH 2 , например NaNH2 – как сильные основания. Аммонооснова-
ния и аммонокислоты в жидком аммиаке вступают в реакцию нейтрализации:
NH4Cl + NaNH2 2NH3 + NaCl.
Амиды, имиды и нитриды – большей частью твердые вещества, разлагаются водой с образованием NH3 и гидроксидов металлов:
NаNH2 + Н2О = NаОН + NH3; Мg3N2 + 6Н2О = 3Мg(ОН)2 + 2NH3.
Свойства нитридов изменяются по периодам и группам периодической системы в зависимости от характера связи:
Na3N |
Mg3N2 |
AlN |
Si3N4 |
P3N5 |
S4N4 |
Cl3N |
основные |
амфотерный |
|
кислотные |
|
||
74
Взависимости от типа химической связи между атомами нитриды подразделяются: 1) на ионные, 2) ковалентные и 3) металлоподобные (ионно-ковалентно-металлические).
Внитридах s-элементов I и II групп периодической системы образуется преимущественно ионная связь. Состав этих нитридов отвечает
обычным валентным соотношениям, например Li3N, Мg3N2. Химически они довольно активны, разлагаются водой (с образованием основания), и кислотами:
2Li3N + 6H2O = 6LiOH + 2NH3; Ca3N2 + 6HCl = 3CaCl2 + 2NH3.
Ковалентными нитридами являются, например, нитриды бора (BN), кремния (Si3N4). Ковалентные нитриды являются диэлектриками и полупроводниками с широкой запрещенной зоной. Нитриды с ковалентной связью (или близкой к ней) устойчивы к воде и кислотам при комнатной температуре.
Нитриды неметаллов хлора и иода Cl3N и I3N – взрывчатые вещества, они разлагаются от удара, трения, нагревания на азот N2 и соответственно хлор Cl2 или иод I2. Растворимые ковалентные нитриды гидролизуют с образованием кислоты:
Cl3N + 3H2O = 3HClO + NH3.
К металлоподобным относят нитриды переходных металлов IV VI групп (TiN, ZrN, TaN). Они обладают значительной твердостью и хрупкостью, высокой электропроводностью, высокими температу-
рами плавления (tпл(TaN) = 3090°С, tпл(TiN) = 3220°С, tпл(ZrN) = 2950°С),
большой стандартной энтальпией образования. Они устойчивы по отношению к воде и кислотам.
Нитриды переходных металлов I и II групп представляют собой непрочные вещества; некоторые из них легко взрываются (Ag3N, Hg3N2, Au3N), а нитриды цинка и кадмия разлагаются водой и кислотами аналогично нитридам ионного типа:
Zn3N2 + 6H2O = 3Zn(OH)2 + 2NH3.
Между нитридами различной природы возможно взаимодействие: Li3N + AlN = Li3AlN2.
Гидразин N2H4. Молекула N2H4 состоит из двух групп NH2, повернутых друг относительно друга, что обусловливает полярность молекулы. Строение молекулы:
75

Гидразин получают окислением аммиака NH3 или мочевины CO(NH2)2 гипохлоритом натрия NaClO:
2NH3 + NaClO = N2H4 + NaCl + H2O;
H2NCONH2 + NaClO + 2NaOH = N2H4 + H2O + NaCl + Na2CO3.
Гидразин – жидкость при стандартных условиях. Смешивается в любых соотношениях с водой, жидким аммиаком, этанолом; в неполярных растворителях растворяется плохо. Гидразин и большинство его производных токсичны.
Молекула гидразина N2H4 достаточно устойчива, несмотря на эндотермичность ( Нf , 298 = 56 кДж/моль), однако менее устойчива, чем
аммиак, так как связь N—N не очень прочна. Разложение гидразина – экзотермическая реакция, протекающая в отсутствие катализаторов при 200–300°С:
3N2H4 t 4NH3 + N2.
Данная реакция является реакцией диспропорционирования, N2H4 проявляет окислительно-восстановительную двойственность.
Благодаря наличию двух неподеленных пар электронов у атомов азота гидразин способен к присоединению одного или двух ионов во-
дорода с образованием соответственно ионов N2H 5 |
и N2H 62 . Водные |
растворы гидразина обладают основными свойствами, но его основность значительно слабее, чем у аммиака:
N2H4 + H2O [N2H5]+ + OH−, (Kb = 3,0 · 10−6).
(для аммиака Kb = 1,78 · 10−5). Протонирование второй неподеленной пары электронов протекает еще труднее:
[N2H5]+ + H2O [N2H6]2+ + OH−, (Kb = 8,4 · 10−16).
Известны соли гидразина – гидрохлорид гидразина (солянокислый гидразин) N2H5Cl, сульфат гидразина N2H6SO4 (сернокислый гидразин) и т. д. Иногда их формулы записывают N2H4 · HCl, N2H4 · H2SO4 и т. п. Получение солей гидразина:
N2H4 + HCl = [N2H5]Cl;
76

N2H4 + 2HCl = [N2H6]Cl2;
N2H4 + H2SO4 = [N2H6]SO4.
Большинство таких солей растворимы в воде. К числу важнейших относится сульфат N2H4 · H2SO4.
При взаимодействии N2H4 с О2 выделяется большое количество тепла:
N2H4 + O2 = N2 + 2H2O, ∆H° = – 621,5 кДж/моль.
Гидразин и его производные широко используются как ракетное горючее.
N2H4 и его производные – сильные восстановители, окисляются чаще всего до N2:
N2H4 + 2I2 = N2 + 4HI;
5N2H4 + 4KMnO4 + 6H2SO4 = 5N2 + 4MnSO4 + 2K2SO4 + 16H2O.
Гидразин более сильный восстановитель, чем NH3. Однако при действии сильных восстановителей может быть окислителем:
N2H4 + Zn + 4HCl = ZnCl2 + 2NH4Cl.
N2H4 входит в состав многих комплексных соединений в качестве лигандов:
ZnCl2 + 2N2H4 = [Zn(N2H4)2]Cl2.
Гидроксиламин NH2OH – производное NH3, в котором один атом водорода замещатся на гидроксогруппу:
Н
N O Н
Н
При взаимодействии с водой гидроксиламин образует гидрат
NH2OH · H2O.
Получают гидроксиламин восстановлением азотной кислоты атомарным водородом при электролизе раствора азотной кислоты:
HNO3 + 6H(атомарный) = NH2OH + 2H2O.
На воздухе соединение является нестабильным и разлагается: 3NH2OH = N2 + NH3 + 3H2O.
Гидроксиламин NH2OH – слабое основание за счет электронной пары азота, в водном растворе диссоциирует по основному типу:
77
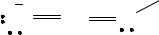
NH2OH + H2O NH3OH+ + OH−, Kb = 2 · 10−8.
Можеттакжедиссоциироватьипокислотномутипу:
NH2OH + H2O H3O+ + NH2O−, Kа = 9,55 · 10−15.
Сравнение констант показывает, что преобладает диссоциация по основному типу.
NH2OH является донором электронной пары, участвует в реакциях присоединения:
NH2OH + HCl = (NH3OH)Cl или NH2OH · HCl.
NH2OH, соли гидроксиламиния (NH3OH)Cl, (NH3OH)HSO4 – восста-
новители, окисляютсяпреимущественнодоN2 (иногдаобразуетсяN2О):
2NH2OH + I2 + 2KOH = 2KI + N2 + 2H2O;
10NH2OH + 2KMnO4 + 3H2SO4 = 5N2 + 2MnSO4 + K2SO4 + 18H2O.
Для NH2OH проявляются также свойства окислителя, может восстанавливатьсядоNH3, NH4+:
2NH2OH + 2FeSO4 + 2H2SO4 = (NH4)2SO4 + Fe2(SO4)3
Важнейшей солью гидроксиламина является NH2OH · HCl. Гидроксиламин и его соли применяются как восстановители в неорганической и органической химии, в медицине.
При взаимодействии гидразина с HNO2 можно получить азоти-
стоводородную кислоту HN3:
N2H4 + HNO2 = HN3 + 2H2O.
Водный раствор HN3 называют азидоводородной кислотой (азотистоводородной кислотой). В растворах азидоводородная кислота – слабая кислота, незначительно диссоциирует на ионы:
HN3 Н+ + N3 , Kдис = 10–5.
Вмолекуле азидоводородной кислоты три атома азота выстроены
влинию, что определяется sp-гибридизацией валентных орбиталей центрального атома азота:
|
+ |
Н |
|
N |
N |
||
N |
Орбитали боковых атомов азота находятся в sp2-гибридном состоянии, атом водорода присоединяется под углом 110°. Центральный атом
78
азота четырехвалентен, что возможно при переносе одного электрона с 2s-орбитали на р-орбиталь концевого атома азота, вследствие чего центральный атом приобретает положительный заряд, а концевой отрицательный.
Кислота HN3 является окислителем. Как и азотная кислота, HN3 растворяет металлы, стоящие в ряду напряжений после водорода. При взаимодействии с металлами образует соль металла, азот и аммиак, образующий соль с избытком HN3:
4HN3 + Cu = Cu(N3)2 + N2 + (NH4)N3.
Смесь азидоводородной кислоты с концентрированной соляной кислотой при нагревании растворяет золото и платину, т. е. ведет себя аналогично «царской водке»:
Pt + 2HN3 + 8HCl = H2[PtCl6] + 2N2 + 2NH4Cl.
Окислительные свойства обусловлены образованием атомарного хлора при взаимодействии HN3 и HCl:
HN3 + 2HCl = Cl2 + N2 + NH3.
Соли азидоводородной кислоты называются азидами. Азиды щелочных металлов термодинамически неустойчивы, однако кинетически инертны и по свойствам напоминают галогениды. Их используют в подушках безопасности. Азиды тяжелых металлов неустойчивы, при нагревании или ударе взрываются. На этом основано применение, например, азида свинца Pb(N3)2 в качестве детонатора:
Pb(N3)2 = Pb + 3N2.
Сильными окислителями HN3 окисляется, как и все соединения азота с отрицательной степенью окисления, до свободного азота:
10HN3 + 2KMnO4 + 3H2SO4 = 15N2 + 2MnSO4 + K2SO4 + 8H2O.
Оксиды азота
В отличие от других элементов, азот образует большое число ок-
сидов: N2O, NO, N2O3, NO2, N2O4, N2O5.
Стандартная энергия Гиббса образования G оf , 298 всех оксидов
больше нуля. Поэтому при обычных условиях непосредственным взаимодействием азота с кислородом (N2 + O2) оксиды получить нельзя. Однако анализ термодинамических характеристик реакции образования NO:
79

N2 + O2 t 2NO, Н298 = 180,6 кДж, S298 = 24 Дж/К
свидетельствует о том, что реакция протекает с возрастанием энтропии и возможна при высокой температуре, так как с увеличением температуры G298 может стать меньше нуля (t > 7000°С). Взаимодей-
ствие азота с кислородом с образованием NO реально можно проводить при t 3000°С:
Классификация оксидов азота
N2O |
NO |
N2O3 |
NO2, N2O4 |
N2O5 |
Несолеобразующие |
соответствует |
Кислотные |
соответствует |
|
|
|
соответствуют |
||
|
|
азотистая |
две кислоты: |
азотная |
|
|
кислота |
HNO2 и HNO3 |
кислота |
|
|
HNO2 |
|
HNO3 |
Оксид азота (I) N2O. Строение молекулы. Молекула N2O линей-
ная, орбитали центрального атома азота находятся в состоянии sp- гибридизации, строение молекулы описывается при помощи двух резонансных структур: N–=N+=O или N N+–O . Связь между атомами азота (0,113 нм) сравнима с длиной тройной связи.
Формально атомы азота в N2O имеют разные степени окисления и валентности, для N–=N+=O образование связей по методу ВС:
2p
2s
N+
N
O
Физические свойства N2O. Бесцветный газ, без запаха, сладковатый на вкус, сравнительно малорастворим в воде, при 0°С 1 объем газа растворяется в 1 объеме воды. При вдыхании вызывает судорожный смех, поэтомуимеетназвание«веселящийгаз».
Химические свойства. Несолеобразующий оксид. Инертное соединение, при обычной температуре не реагирует с галогенами, с во-
80
