
- •А.Л.Галкин, в.К.Османов химия
- •Isbn 978-5-502-00158-8 © нгту им. Р.Е. Алексеева, 2013
- •Введение
- •Классификация неорганических веществ
- •Аллотропия
- •1.4 Соли
- •Комплексные соли
- •Генетическая связь между различными классами соединений
- •Основание Кислота Примеры
- •Основные понятия и законы химии
- •Закон сохранения массы
- •Закон постоянства состава
- •Закон эквивалентов
- •Закон авогадро
- •Уравнение состояния идеального газа
- •3. Строение атома
- •3.1. Квантовые числа
- •3.2. Принципы заполнения атомных орбиталей
- •3.3. Полная электронная формула атома
- •3.4. Периодический закон элементов д. И. Менделеева
- •Физический смысл химической периодичности
- •4. Химическая связь и строение молекул
- •4.1. Физические основы образования молекул
- •4.2. Метод валентных связей (метод вс)
- •Значения длины и энергии связи у галогеноводородных кислот
- •Взаимосвязь кратности, длины и энергии связи с - с, с - о и n - n
- •Одна s-орбиталь и одна p-орбиталь превращаются в две одинаковые «гибридные» орбитали, угол между осями которых равен 180°:
- •4.3. Метод молекулярных орбиталей
- •Энергия, длина и порядок связи в молекулах элементов I периода
- •4.4. Металлическая связь
- •4.5. Межмолекулярные взаимодействия
- •5. Энергетика и направление химических процесов
- •5.1. Термодинамическая система и ее состояния
- •5.2. Изменение свойств термодинамической системы
- •5.3. Энергия, работа, теплота
- •5.4. Обратимые и необратимые процессы
- •5.5. Первый закон термодинамики
- •5.6. Направление химических реакций
- •Второй закон термодинамики
- •Постулат планка (третий закон термодинамики)
- •6. Скорость химических реакций и и химическое равновесие
- •6.1. Влияние концентрации реагентов на скорость реакции
- •6.2. Влияние температуры на скорость реакции
- •6.3. Влияние катализатора на скорость реакции
- •А) без катализатора и б) в присутствии катализатора
- •6.4. Скорость гетерогенных химических реакций
- •6.5. Химическое равновесие
- •6.5.1. Влияние внешних факторов на состояние равновесия
- •7. Растворы
- •7.1. Вода
- •Вода в природе
- •7.2. Образование растворов
- •7.3. Способы выражения концентраций растворов
- •7.4. Растворы электролитов
- •7.4.2. Равновесные процессы в растворах электролитов
- •Цвета кислотно-основных индикаторов в зависимости от рН раствора
- •8. Окислительно – восстановительные реакции
- •8.1. Степень окисления
- •8.2. Типичные окислители и восстановители
- •8.3. Классификация окислительно-восстановительных реакций
- •8.4. Составление уравнений окислительно-восстановительных реакций
- •9. Основы электрохимических процессов
- •9.1. Измерение стандартных электродных потенциалов
- •9.2. Направление окислительно-восстановительных реакций
- •9.3. Влияние внешних факторов на величину электродного потенциала
- •9.4. Законы фарадея
- •9.5. Элементы технической электрохимии
- •10. Коррозионные процессы
- •10.1. Электрохимическая коррозия
- •10.2. Кинетика коррозионных процессов
- •10.3.Методы защиты металлов от коррозии
- •11. Номенклатура и классификация органических соединений
- •11.1. Номенклатура органических соединений
- •11. 2. Классификация органических соединений по номенклатуре июпак
- •12. Высокомолекулярные соединения
- •12.1. Классификация высокомолекулярных соединений
- •12.1.1. Классификация высокомолекулярных соединений по структуре макромолекул
- •12.1.2. Классификация полимеров по поведению при нагревании
- •12.2. Сополимеры
- •12.3. Синтез высокомолекулярных соединений
- •12.4. Свойства полимеров
- •12.5. Важнейшие полимерные материалы
- •Примеры решения задач
- •1.Основные понятия и законы химии
- •Строение атома
- •Химическая связь и строение молекул
- •Задача 4.
- •Молекула bf3 . Электронная формула атома бора 5b - 2s22p1. При образовании трех -связей атом бора переходит в возбужденное состояние
- •Решение. Последовательность действий для предсказания геометрии молекул на основании теории локализованных электронных пар следующая:
- •1.Подсчитывают число валентных электронов молекулы или иона и записывают электронную валентную структуру (льюисову структуру);
- •2.По валентной структуре определяют число -связывающих и несвязывающих электронных пар, т.Е. Тип молекулы aBnEm (n – число - связей, m – число несвязывающих электронных пар);
- •Энергетика и направление химических процессов
- •4 Моль н2 – - 150,8 кДж
- •Скорость химических реакций и химическое равновесие Задача 1
- •Растворы Примеры решения задач
- •Окислительно-восстановительные реакции примеры решения типовых задач
- •Основы электрохимических процессов
- •Коррозионные процессы
- •Галкин Андрей Львович Османов Владимир Кимович
- •603950, Нижний Новгород, ул.Минина, 24.
Энергия, длина и порядок связи в молекулах элементов I периода
| |||||||||||||||||||||||||||||||||||
Чем выше порядок связи, тем, при прочих равных условиях, прочнее данная молекула, что подтверждается экспериментальными данными. Наличие на МО хотя бы одного неспаренного электрона придает частице парамагнитные свойства и заставляет ее втягиваться в магнитное поле. Если все электроны спарены, то частица обладает диамагнитными свойствами и магнитным полем выталкивается.
39
4.4. Металлическая связь
Атомы металлов отличаются от атомов других элементов тем, что имеют малые энергии ионизации и сравнительно слабо удерживают свои внешние электроны. Поэтому в кристаллической решетке металла большое количество электронов покидает свои атомы, превращая их в положительно заряженные ионы. «Обобществленные» электроны передвигаются в междоузлиях кристаллической решетки и за счет электростатических сил «цементируют» ионы металла. Такая связь называется металлической и существует не только в твердых кристаллах металлов, но и в расплавах и в аморфном состоянии.
Единая система электронов в металлических веществах называется «электронным газом». Металл можно представить в виде остова из положительных ионов, погруженного в электронный газ, который компенсирует силы взаимного отталкивания положительных ионов. В свою очередь, “электронный газ” может свободно двигаться через решетку, состоящую из ионов металла обеспечивая его высокую электропроводность, теплопроводность и ковкость . В кристаллах металлов атомы ионизированы не полностью, и часть валентных электронов остается связанной. В результате возможно появление частично ковалентных связей между соседними атомами. Вклады ионной и ковалентной составляющей обнаружены во многих металлах. Металлическая связь имеет признаки, характерные как для ковалентной, так и для ионной связи.
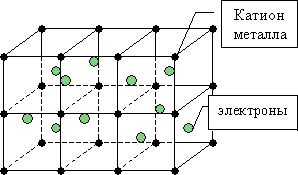
Рис. 4.9. Схематическое строение элементарной решетки металла
Электропроводность металлов уменьшается с ростом температуры. Это объясняется тем, что электроны в металле беспорядочно движутся, переходя от одного атома к другому. А положительно заряженные ионы лишь слегка колеблются около своего положения в кристаллической решетке. При нагревании металла колебания катионов усиливаются и электронам становится труднее продвигаться между ними, поэтому электрическое сопротивление металла увеличивается.
Наличие свободных электронов обусловливает высокую теплопроводность металлов и характерный металлический блеск. Их высокая пластичность и ковкость связаны с возможностью взаимного смещения катионов в металлической кристаллической решетке без разрыва химической связи.
Описываемая картина электростатического связывания ионов металла в решетке с помощью «электронного газа» слишком упрощена. В пользу этого свидетельствует следующее. Если бы ионы металлов были связаны только
40
делокализованными электронами, то все металлические системы были бы похожи: чем больше свободных электронов и меньше атомный радиус металла, тем в большей степени за счет электростатического притяжения фиксировались бы ионы металла в узлах решетки и тем прочнее должен бы быть металл. Но таких простых корреляций не наблюдается. Например, щелочные металлы легко теряют электроны, имеют высокую электропроводность, но они очень мягкие. Медь, серебро и золото также хорошо проводят электрический ток, но они на порядок тверже. Так, в гранецентрированной кубической решетке кристалла меди каждый атом окружен 12 другими атомами. Медь достаточно твердый металл, имеет высокую температуру плавления Тпл = 1100 оС и плотность 8,9 г/см3.
В решетку типа «меди» кристаллизуются такие прочные и твердые металлы, как: γ-Fe, Ni, Rh, Pd, Ir, Pt, Аи. Однако такие металлы, как Мg, А1 и Рb, тоже имеют гранецентрированную кубическую решетку, но их, в отличие от меди, можно резать ножом, и они сильно отличаются по плотности и температурам плавления, например: Мg (ρ =1,74 г/см3, Тпл = 700 оС); Рb (ρ =11,34 г/см3 , Тпл = 327 оС).
Таким образом, количество свободных электронов и тип кристаллической решетки не являются определяющими при формировании механических и физических свойств металлов.
Для объяснения причин образования связей в металлах было предложено несколько теорий (теория резонансной связи Полинга, зонная теория, метод молекулярных орбиталей), каждая из которых внесла свой вклад в понимание вопроса и которые в той или иной мере дополняют друг друга.
