
- •А.Л.Галкин, в.К.Османов химия
- •Isbn 978-5-502-00158-8 © нгту им. Р.Е. Алексеева, 2013
- •Введение
- •Классификация неорганических веществ
- •Аллотропия
- •1.4 Соли
- •Комплексные соли
- •Генетическая связь между различными классами соединений
- •Основание Кислота Примеры
- •Основные понятия и законы химии
- •Закон сохранения массы
- •Закон постоянства состава
- •Закон эквивалентов
- •Закон авогадро
- •Уравнение состояния идеального газа
- •3. Строение атома
- •3.1. Квантовые числа
- •3.2. Принципы заполнения атомных орбиталей
- •3.3. Полная электронная формула атома
- •3.4. Периодический закон элементов д. И. Менделеева
- •Физический смысл химической периодичности
- •4. Химическая связь и строение молекул
- •4.1. Физические основы образования молекул
- •4.2. Метод валентных связей (метод вс)
- •Значения длины и энергии связи у галогеноводородных кислот
- •Взаимосвязь кратности, длины и энергии связи с - с, с - о и n - n
- •Одна s-орбиталь и одна p-орбиталь превращаются в две одинаковые «гибридные» орбитали, угол между осями которых равен 180°:
- •4.3. Метод молекулярных орбиталей
- •Энергия, длина и порядок связи в молекулах элементов I периода
- •4.4. Металлическая связь
- •4.5. Межмолекулярные взаимодействия
- •5. Энергетика и направление химических процесов
- •5.1. Термодинамическая система и ее состояния
- •5.2. Изменение свойств термодинамической системы
- •5.3. Энергия, работа, теплота
- •5.4. Обратимые и необратимые процессы
- •5.5. Первый закон термодинамики
- •5.6. Направление химических реакций
- •Второй закон термодинамики
- •Постулат планка (третий закон термодинамики)
- •6. Скорость химических реакций и и химическое равновесие
- •6.1. Влияние концентрации реагентов на скорость реакции
- •6.2. Влияние температуры на скорость реакции
- •6.3. Влияние катализатора на скорость реакции
- •А) без катализатора и б) в присутствии катализатора
- •6.4. Скорость гетерогенных химических реакций
- •6.5. Химическое равновесие
- •6.5.1. Влияние внешних факторов на состояние равновесия
- •7. Растворы
- •7.1. Вода
- •Вода в природе
- •7.2. Образование растворов
- •7.3. Способы выражения концентраций растворов
- •7.4. Растворы электролитов
- •7.4.2. Равновесные процессы в растворах электролитов
- •Цвета кислотно-основных индикаторов в зависимости от рН раствора
- •8. Окислительно – восстановительные реакции
- •8.1. Степень окисления
- •8.2. Типичные окислители и восстановители
- •8.3. Классификация окислительно-восстановительных реакций
- •8.4. Составление уравнений окислительно-восстановительных реакций
- •9. Основы электрохимических процессов
- •9.1. Измерение стандартных электродных потенциалов
- •9.2. Направление окислительно-восстановительных реакций
- •9.3. Влияние внешних факторов на величину электродного потенциала
- •9.4. Законы фарадея
- •9.5. Элементы технической электрохимии
- •10. Коррозионные процессы
- •10.1. Электрохимическая коррозия
- •10.2. Кинетика коррозионных процессов
- •10.3.Методы защиты металлов от коррозии
- •11. Номенклатура и классификация органических соединений
- •11.1. Номенклатура органических соединений
- •11. 2. Классификация органических соединений по номенклатуре июпак
- •12. Высокомолекулярные соединения
- •12.1. Классификация высокомолекулярных соединений
- •12.1.1. Классификация высокомолекулярных соединений по структуре макромолекул
- •12.1.2. Классификация полимеров по поведению при нагревании
- •12.2. Сополимеры
- •12.3. Синтез высокомолекулярных соединений
- •12.4. Свойства полимеров
- •12.5. Важнейшие полимерные материалы
- •Примеры решения задач
- •1.Основные понятия и законы химии
- •Строение атома
- •Химическая связь и строение молекул
- •Задача 4.
- •Молекула bf3 . Электронная формула атома бора 5b - 2s22p1. При образовании трех -связей атом бора переходит в возбужденное состояние
- •Решение. Последовательность действий для предсказания геометрии молекул на основании теории локализованных электронных пар следующая:
- •1.Подсчитывают число валентных электронов молекулы или иона и записывают электронную валентную структуру (льюисову структуру);
- •2.По валентной структуре определяют число -связывающих и несвязывающих электронных пар, т.Е. Тип молекулы aBnEm (n – число - связей, m – число несвязывающих электронных пар);
- •Энергетика и направление химических процессов
- •4 Моль н2 – - 150,8 кДж
- •Скорость химических реакций и химическое равновесие Задача 1
- •Растворы Примеры решения задач
- •Окислительно-восстановительные реакции примеры решения типовых задач
- •Основы электрохимических процессов
- •Коррозионные процессы
- •Галкин Андрей Львович Османов Владимир Кимович
- •603950, Нижний Новгород, ул.Минина, 24.
7.4. Растворы электролитов
Понятие электролит восходит к середине XIX века и было введено М.Фарадеем для обозначения веществ, растворы которые проводят электрический ток (электролит – «разлагаемый током»). Фарадей считал, что распад молекулярных веществ на заряженные частицы в растворе происходит лишь под действием внешнего электрического поля. Эти предположения оказались верны только для растворов очень слабых электролитов при громадной напряженности внешнего поля. Сильные электролиты распадаются на ионы в растворе без наложения электрических полей.
В настоящее время чаще используют обобщенное понятие электролитов. Это вещества или системы, обладающие ионным типом проводимости (проводники второго рода). Они бывают твердыми, жидкими и даже газообразными.
Свойства растворов, проводящих электрический ток, не подчиняются законам Рауля и Вант Гоффа. С целью формального учета этого отклонения Вант Гофф ввел в уравнение коэффициент, названный изотоническим коэффициентом i, причем для одного и того же раствора величина изотонического коэффициента
одинакова и для законов Рауля.
Эти наблюдения позволили сделать вывод о том, что количество частиц в растворе, проводящем ток, существенно больше, чем можно было ожидать, учитывая лишь число молекул растворенного вещества, то есть число частиц в растворах электролитов и неэлектролитов одной и той же молярности существенно различается.
Различия в свойствах растворов, проводящих и не проводящих электрический ток, впервые были объяснены в рамках теории, получившей название «теория электролитической диссоциации».
78
7.4.1. ТЕОРИЯ ЭЛЕКТРОЛИТИЧЕСКОЙ ДИССОЦИАЦИИ
Эта теория была сформулирована в 1883-1887 годах шведским ученым С.Аррениусом. Дальнейшее развитие теория получила в трудах Оствальда, Вальдена, Писаржевского и др. Теория электролитической диссоциации базируется на трех постулатах:
1-й Постулат. Некоторые вещества, называемые электролиты, обладают способностью при растворении распадаться на противоположно заряженные частицы, называемые ионами.
Процесс распада веществ на ионы под действием растворителя называется электролитической диссоциацией.
Электролиты - это проводники второго рода, т.е. в отличие от металлов, где переносчиками зарядов являются электроны, в растворе заряды переносятся ионами. Величина и знак заряда ионов, а также их число зависят от природы электролита. Различают три типа электролитов:
-Бинарные NaCl, ZnSO4, НCl. Распадаются на два иона:
NaCl ↔ Na+ + Cl-, ZnSO4 ↔ Zn2+ + SO42-
-Тернарные Na2SO4, CaCl2. Распадаются на три иона:
Na2SO4↔ 2Na+ + SO42-, CaCl2 ↔ Ca2+ + 2Cl-
-Квартернарные K3PO4, Al(NO3)3. Распадаются на четыре иона:
K3PO4 ↔ 3K+ + PO43- , Al(NO3)3 ↔ Al3+ + 3NO3-
Второй и третий тип электролитов являются несимметричными.
Так как исходные молекулы являются электронейтральными, а заряды ионов образуются в процессе распада этих молекул за счет перехода электронов от катионов к анионам, то при написании реакций диссоциации необходимо соблюдать принцип электронейтральности. Суммарный заряд катионов должен равняться суммарному заряду анионов.
2-й Постулат. Электролиты при растворении распадаются на ионы не полностью, и поэтому только часть молекул присутствует в растворе в виде ионов.
Величина, характеризующая долю молекул, распавшихся на ионы в состоянии равновесия, называется степенью диссоциации ().
=
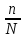 ,
(7.9)
,
(7.9)
где n – число распавшихся на ионы молекул, N - общее количество растворенных молекул.
Степень диссоциации зависит от температуры, типа растворителя, от природы электролита и его концентрации. Условно принимают, что если > 30%, то электролит считается сильным, если < 3%, то электролит слабый. Чем выше концентрация раствора, тем степень диссоциации меньше, так как при увеличении концентрации усиливается процесс ассоциации ионов в молекулы.
79
Второй количественной характеристикой электролита является табличная величина, называемая константа диссоциации Кд, которая является константой равновесия в процессе электролитической диссоциации.
AnBm
= nA
m+
+ mBn-
Кд
=
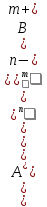 . (7.10)
. (7.10)
Если электролит бинарный, то АВ ↔ А+ + В-
Кд
=
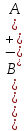 . (7.11)
. (7.11)
Обозначим
исходную концентрацию электролита как
С (моль/л),
а степень его диссоциации .
Тогда концентрация катионов и
анионов будут равны
[A+]
= [B-]
= C,
a
концентрация нераспавшейся части
молекул [AB]=(1-) C.
Подставим эти выражения в уравнение
для константы диссоциации (11.7), получим
C.
Подставим эти выражения в уравнение
для константы диссоциации (11.7), получим
Кд
=
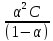 . (7.12)
. (7.12)
Это уравнение было получено Оствальдом и выражает закон разведения. Константа диссоциации, в отличие от степени диссоциации, не зависит от концентрации и определяется природой электролита и температурой. Для очень слабых электролитов → 0 и выражение (12.7) преобразуется в более простое:
Кд= 2С . (7.13)
Соотношение (13.7) справедливо только для слабых симметричных бинарных электролитов. В более сложных случаях это выражение усложняется.
3-й Постулат. Взаимодействие между ионами отсутствует, и растворы электролитов ведут себя подобно идеальным.
Этот постулат лежит в основе всех количественных соотношений теории. Именно этот постулат определил границы применимости теории для количественных расчетов. Уравнения могут быть использованы только для очень
разбавленных растворов, в которых ион-ионное взаимодействие стремится к нулю.
Теория электролитической диссоциации позволила научно определить понятие кислоты и основания, буферной емкости, создать теорию индикаторов, объяснить процессы ступенчатой диссоциации, процесс гидролиза солей и т.п.
Наряду с достоинствами, теория электролитической диссоциации имеет ряд существенных недостатков. Она игнорирует взаимодействие ионов с диполями растворителя, т.е. ион-дипольное взаимодействие. А именно это взаимодействие и является причиной диссоциации электролита на ионы в растворе.
Теория Аррениуса не смогла ответить на вопрос о причинах электролитической диссоциации и процесса образования устойчивых ионных систем. Игнорирование процессов ион-ионного взаимодействия значительно ограничивает границы применимости теории. Ионы рассматриваются как частицы идеального газа и, следовательно, не учитывается обусловленное кулоновским
80
взаимодействием притяжение и отталкивание заряженных частиц. Пренебрежение ион-ионным взаимодействием приводит к нарушению количественных взаимосвязей в теории. Так, например, экспериментальная проверка уравнения константы диссоциации показывает, что она не остается постоянной, а изменяется с концентрацией электролита. Наиболее отчетливо это прослеживается для сильных электролитов. Игнорирование ион-ионного взаимодействия проявляется также и в том, что различные методы определения степени диссоциации электролитов приводят к различным результатам. В некоторых случаях для концентрированных растворов сильных электролитов получаются значения степени диссоциации больше единицы, что лишено физического смысла.
Более поздние работы были направлены в основном, на учет этих взаимодействий внутри растворов, что привело к созданию современных теорий растворов электролитов.
