
- •А.Л.Галкин, в.К.Османов химия
- •Isbn 978-5-502-00158-8 © нгту им. Р.Е. Алексеева, 2013
- •Введение
- •Классификация неорганических веществ
- •Аллотропия
- •1.4 Соли
- •Комплексные соли
- •Генетическая связь между различными классами соединений
- •Основание Кислота Примеры
- •Основные понятия и законы химии
- •Закон сохранения массы
- •Закон постоянства состава
- •Закон эквивалентов
- •Закон авогадро
- •Уравнение состояния идеального газа
- •3. Строение атома
- •3.1. Квантовые числа
- •3.2. Принципы заполнения атомных орбиталей
- •3.3. Полная электронная формула атома
- •3.4. Периодический закон элементов д. И. Менделеева
- •Физический смысл химической периодичности
- •4. Химическая связь и строение молекул
- •4.1. Физические основы образования молекул
- •4.2. Метод валентных связей (метод вс)
- •Значения длины и энергии связи у галогеноводородных кислот
- •Взаимосвязь кратности, длины и энергии связи с - с, с - о и n - n
- •Одна s-орбиталь и одна p-орбиталь превращаются в две одинаковые «гибридные» орбитали, угол между осями которых равен 180°:
- •4.3. Метод молекулярных орбиталей
- •Энергия, длина и порядок связи в молекулах элементов I периода
- •4.4. Металлическая связь
- •4.5. Межмолекулярные взаимодействия
- •5. Энергетика и направление химических процесов
- •5.1. Термодинамическая система и ее состояния
- •5.2. Изменение свойств термодинамической системы
- •5.3. Энергия, работа, теплота
- •5.4. Обратимые и необратимые процессы
- •5.5. Первый закон термодинамики
- •5.6. Направление химических реакций
- •Второй закон термодинамики
- •Постулат планка (третий закон термодинамики)
- •6. Скорость химических реакций и и химическое равновесие
- •6.1. Влияние концентрации реагентов на скорость реакции
- •6.2. Влияние температуры на скорость реакции
- •6.3. Влияние катализатора на скорость реакции
- •А) без катализатора и б) в присутствии катализатора
- •6.4. Скорость гетерогенных химических реакций
- •6.5. Химическое равновесие
- •6.5.1. Влияние внешних факторов на состояние равновесия
- •7. Растворы
- •7.1. Вода
- •Вода в природе
- •7.2. Образование растворов
- •7.3. Способы выражения концентраций растворов
- •7.4. Растворы электролитов
- •7.4.2. Равновесные процессы в растворах электролитов
- •Цвета кислотно-основных индикаторов в зависимости от рН раствора
- •8. Окислительно – восстановительные реакции
- •8.1. Степень окисления
- •8.2. Типичные окислители и восстановители
- •8.3. Классификация окислительно-восстановительных реакций
- •8.4. Составление уравнений окислительно-восстановительных реакций
- •9. Основы электрохимических процессов
- •9.1. Измерение стандартных электродных потенциалов
- •9.2. Направление окислительно-восстановительных реакций
- •9.3. Влияние внешних факторов на величину электродного потенциала
- •9.4. Законы фарадея
- •9.5. Элементы технической электрохимии
- •10. Коррозионные процессы
- •10.1. Электрохимическая коррозия
- •10.2. Кинетика коррозионных процессов
- •10.3.Методы защиты металлов от коррозии
- •11. Номенклатура и классификация органических соединений
- •11.1. Номенклатура органических соединений
- •11. 2. Классификация органических соединений по номенклатуре июпак
- •12. Высокомолекулярные соединения
- •12.1. Классификация высокомолекулярных соединений
- •12.1.1. Классификация высокомолекулярных соединений по структуре макромолекул
- •12.1.2. Классификация полимеров по поведению при нагревании
- •12.2. Сополимеры
- •12.3. Синтез высокомолекулярных соединений
- •12.4. Свойства полимеров
- •12.5. Важнейшие полимерные материалы
- •Примеры решения задач
- •1.Основные понятия и законы химии
- •Строение атома
- •Химическая связь и строение молекул
- •Задача 4.
- •Молекула bf3 . Электронная формула атома бора 5b - 2s22p1. При образовании трех -связей атом бора переходит в возбужденное состояние
- •Решение. Последовательность действий для предсказания геометрии молекул на основании теории локализованных электронных пар следующая:
- •1.Подсчитывают число валентных электронов молекулы или иона и записывают электронную валентную структуру (льюисову структуру);
- •2.По валентной структуре определяют число -связывающих и несвязывающих электронных пар, т.Е. Тип молекулы aBnEm (n – число - связей, m – число несвязывающих электронных пар);
- •Энергетика и направление химических процессов
- •4 Моль н2 – - 150,8 кДж
- •Скорость химических реакций и химическое равновесие Задача 1
- •Растворы Примеры решения задач
- •Окислительно-восстановительные реакции примеры решения типовых задач
- •Основы электрохимических процессов
- •Коррозионные процессы
- •Галкин Андрей Львович Османов Владимир Кимович
- •603950, Нижний Новгород, ул.Минина, 24.
9.1. Измерение стандартных электродных потенциалов
Как
уже отмечалось выше, измерение абсолютного
значения межфазного скачка потенциала
невозможно. В электрохимии для решения
этого вопроса используют следующий
прием. Выбрана электродная система,
потенциал которой условно принят за
ноль. В качестве такой системы принят
«стандартный водородный электрод»
(СВЭ). Он представляет из себя полуэлемент,
в котором скачок потенциала определяется
равновесием между ионами и атомами
водорода Н+
+
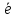 = Н0.
При стандартных условиях, когда
концентрация ионов водорода в электролите
равна 1 моль/л, а давление газообразного
водорода, подаваемого в полуэлемент
равно 1 атмосфере, потенциал данной
системы принят за ноль.
= Н0.
При стандартных условиях, когда
концентрация ионов водорода в электролите
равна 1 моль/л, а давление газообразного
водорода, подаваемого в полуэлемент
равно 1 атмосфере, потенциал данной
системы принят за ноль.
Для измерения электродных потенциалов других систем собирается гальванический элемент, состоящий из измеряемого полуэлемента, в котором концентрация потенциалопределяющих частиц 1 моль/л и стандартного водородного электрода. Разность потенциалов между данными полуэлементами определяет стандартную электродвижущую силу (ЭДС) гальванического элемента (ΔЕ0), которая рассчитывается как разность потенциалов между полуэлементом, где идет реакция восстановления (катод), и полуэлементом, в котором протекает реакция окисления (анод). Электродвижущая сила гальванического элемента легко поддается измерению вольтметрами с высоким входным сопротивлением. Допустим, что катодом является система с неизвестным потенциалом, тогда ΔЕ0= Е0Кt – E0свэ. Учитывая, что E0свэ принят за ноль, ЭДС данного гальванического элемента фактически будет равна стандартному электродному потенциалу неизвестной системы ΔЕ0= Е0Кt.
Описанным выше методом проведены измерения очень большого числа окислительно-восстановительных систем. Результаты этих измерений сведены в таблицы «стандартных электродных потенциалов».
98
9.2. Направление окислительно-восстановительных реакций
Направление самопроизвольного протекания ОВР определяется так же, как и у всех других реакций, – по знаку изменения свободной энергии Гиббса (ΔGхр). Если в результате реакции свободная энергия системы убывает, то такая реакция термодинамически разрешена (ΔGхр<0).
Для окислительно-восстановительных реакций существует взаимосвязь между изменением стандартной свободной энергии и электродвижущей силой
ΔG0хр = -nFΔЕ0. (9.2)
В этом уравнении n - число электронов, участвующих в ОВР, ΔЕ0 – стандартная ЭДС окислительно-восстановительной системы, F – число Фарадея. По физическому смыслу F – это заряд 1 моль электронов.
F
= qeNa=
1,6∙10-19Кл
∙6.022∙1023моль-1=
96352Кл/моль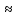 96500
Кл/моль = =26,8 А∙час/моль. Эту величину
часто называют одним фарадеем.
96500
Кл/моль = =26,8 А∙час/моль. Эту величину
часто называют одним фарадеем.
В уравнении 2.9 - n и F константы. Условие самопроизвольности реакции ΔG0хр < 0 означает, что окислительно-восстановительная реакция термодинамически разрешена, если ΔЕ > 0. В свою очередь ЭДС рассчитывается как разность потенциала окислителя и восстановителя ΔЕ= Еок – Eвосс > 0.
Из этого соотношения следует, что ОВР будет протекать самопроизвольно в прямом направлении, если Еок > Eвосс.
В качестве примера вернемся к ур.1.9 и определим по таблице значения стандартных электродных потенциалов полуреакций.
Sn2+
- 2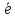 = Sn4+
Е0восс
= +0,151 В
= Sn4+
Е0восс
= +0,151 В
2
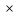 Fe3+
+
Fe3+
+
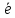 = Fe2+
Е0ок
= +0,771 В
= Fe2+
Е0ок
= +0,771 В

Sn2+ +2Fe3+ = Sn4+ + 2Fe2+
В данном примере ΔЕ= Еок – Eвосс = +0,771 – (+0,151) = +0,65В > 0, а Еок > Eвосс. Реакция 9.1 будет протекать в стандартных условиях самопроизвольно в прямом направлении.
Реальные ОВР начинают протекать самопроизвольно с заметной скоростью, если ЭДС системы превышает 0,4 В.
