
- •А.Л.Галкин, в.К.Османов химия
- •Isbn 978-5-502-00158-8 © нгту им. Р.Е. Алексеева, 2013
- •Введение
- •Классификация неорганических веществ
- •Аллотропия
- •1.4 Соли
- •Комплексные соли
- •Генетическая связь между различными классами соединений
- •Основание Кислота Примеры
- •Основные понятия и законы химии
- •Закон сохранения массы
- •Закон постоянства состава
- •Закон эквивалентов
- •Закон авогадро
- •Уравнение состояния идеального газа
- •3. Строение атома
- •3.1. Квантовые числа
- •3.2. Принципы заполнения атомных орбиталей
- •3.3. Полная электронная формула атома
- •3.4. Периодический закон элементов д. И. Менделеева
- •Физический смысл химической периодичности
- •4. Химическая связь и строение молекул
- •4.1. Физические основы образования молекул
- •4.2. Метод валентных связей (метод вс)
- •Значения длины и энергии связи у галогеноводородных кислот
- •Взаимосвязь кратности, длины и энергии связи с - с, с - о и n - n
- •Одна s-орбиталь и одна p-орбиталь превращаются в две одинаковые «гибридные» орбитали, угол между осями которых равен 180°:
- •4.3. Метод молекулярных орбиталей
- •Энергия, длина и порядок связи в молекулах элементов I периода
- •4.4. Металлическая связь
- •4.5. Межмолекулярные взаимодействия
- •5. Энергетика и направление химических процесов
- •5.1. Термодинамическая система и ее состояния
- •5.2. Изменение свойств термодинамической системы
- •5.3. Энергия, работа, теплота
- •5.4. Обратимые и необратимые процессы
- •5.5. Первый закон термодинамики
- •5.6. Направление химических реакций
- •Второй закон термодинамики
- •Постулат планка (третий закон термодинамики)
- •6. Скорость химических реакций и и химическое равновесие
- •6.1. Влияние концентрации реагентов на скорость реакции
- •6.2. Влияние температуры на скорость реакции
- •6.3. Влияние катализатора на скорость реакции
- •А) без катализатора и б) в присутствии катализатора
- •6.4. Скорость гетерогенных химических реакций
- •6.5. Химическое равновесие
- •6.5.1. Влияние внешних факторов на состояние равновесия
- •7. Растворы
- •7.1. Вода
- •Вода в природе
- •7.2. Образование растворов
- •7.3. Способы выражения концентраций растворов
- •7.4. Растворы электролитов
- •7.4.2. Равновесные процессы в растворах электролитов
- •Цвета кислотно-основных индикаторов в зависимости от рН раствора
- •8. Окислительно – восстановительные реакции
- •8.1. Степень окисления
- •8.2. Типичные окислители и восстановители
- •8.3. Классификация окислительно-восстановительных реакций
- •8.4. Составление уравнений окислительно-восстановительных реакций
- •9. Основы электрохимических процессов
- •9.1. Измерение стандартных электродных потенциалов
- •9.2. Направление окислительно-восстановительных реакций
- •9.3. Влияние внешних факторов на величину электродного потенциала
- •9.4. Законы фарадея
- •9.5. Элементы технической электрохимии
- •10. Коррозионные процессы
- •10.1. Электрохимическая коррозия
- •10.2. Кинетика коррозионных процессов
- •10.3.Методы защиты металлов от коррозии
- •11. Номенклатура и классификация органических соединений
- •11.1. Номенклатура органических соединений
- •11. 2. Классификация органических соединений по номенклатуре июпак
- •12. Высокомолекулярные соединения
- •12.1. Классификация высокомолекулярных соединений
- •12.1.1. Классификация высокомолекулярных соединений по структуре макромолекул
- •12.1.2. Классификация полимеров по поведению при нагревании
- •12.2. Сополимеры
- •12.3. Синтез высокомолекулярных соединений
- •12.4. Свойства полимеров
- •12.5. Важнейшие полимерные материалы
- •Примеры решения задач
- •1.Основные понятия и законы химии
- •Строение атома
- •Химическая связь и строение молекул
- •Задача 4.
- •Молекула bf3 . Электронная формула атома бора 5b - 2s22p1. При образовании трех -связей атом бора переходит в возбужденное состояние
- •Решение. Последовательность действий для предсказания геометрии молекул на основании теории локализованных электронных пар следующая:
- •1.Подсчитывают число валентных электронов молекулы или иона и записывают электронную валентную структуру (льюисову структуру);
- •2.По валентной структуре определяют число -связывающих и несвязывающих электронных пар, т.Е. Тип молекулы aBnEm (n – число - связей, m – число несвязывающих электронных пар);
- •Энергетика и направление химических процессов
- •4 Моль н2 – - 150,8 кДж
- •Скорость химических реакций и химическое равновесие Задача 1
- •Растворы Примеры решения задач
- •Окислительно-восстановительные реакции примеры решения типовых задач
- •Основы электрохимических процессов
- •Коррозионные процессы
- •Галкин Андрей Львович Османов Владимир Кимович
- •603950, Нижний Новгород, ул.Минина, 24.
Введение
Химия – это одна из естественных наук. Она имеет дело со свойствами веществ в зависимости от их состава, строения и внешних условий. Изучение химии – это изучение законов, управляющих превращениями веществ. Химические реакции сводятся к взаимодействию самых внешних электронных оболочек (валентных орбиталей) атомов, в результате чего образуются новые химические связи, при этом исходные вещества (реагенты) исчезают, а новые вещества (продукты) образуются. Результатом химической реакции может быть изменение состава, структуры или заряда реагирующих частиц, при этом химическая природа атомов (заряд их ядра) не изменяется. Это объясняется тем, что энергия связи между элементарными частицами внутри атомного ядра в миллионы раз превышает энергию химической связи, образуемой электронными облаками.
Обычно химию как фундаментальную науку подразделяют на органическую и неорганическую. Органическая химия − это химия соединений углерода, неорганическая химия − это химия всех остальных элементов. В свою очередь эти науки состоят из особых разделов, имеющих собственные названия: общая химия, физическая химия, аналитическая химия, биохимия, химическая технология и другие.
Химию можно рассматривать в двух аспектах. Описательная химия занимается открытием явлений и их описанием. Теоретическая химия включает в себя разработку теорий, позволяющих после проверки обнаруженных фактов обобщить и представить их в виде теории, объясняющей природу некоторого круга явлений. Теория имеет право на существование до тех пор, пока вновь накопившиеся экспериментальные факты не начнут опровергать ее основные положения.
5
Классификация неорганических веществ
Простые вещества. Молекулы состоят из атомов одного вида (атомов одного элемента). В химических реакциях они не могут разлагаться с образованием других веществ.
Сложные вещества (или химические соединения). Молекулы состоят из атомов разного вида (атомов различных химических элементов). В химических реакциях разлагаются с образованием нескольких других веществ.
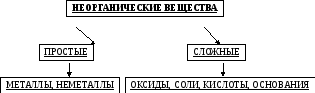
Рис.1.1. Классификация
Резкой границы между металлами и неметаллами нет, так как есть простые вещества, проявляющие двойственные свойства.
Аллотропия
Это способность некоторых химических элементов образовывать несколько простых веществ, различающихся по строению и свойствам.
С - алмаз, графит, карбин, фуллерен и др.
O - кислород, озон.
S - ромбическая, моноклинная, пластическая.
P - белый, красный, чёрный и др.
Явление аллотропии вызывается двумя причинами:
- различным числом атомов в молекуле, например кислород O2 и озон O3;
- образованием различных кристаллических форм, например алмаз и графит.
1.1. ОСНОВАНИЯ
Основания - это сложные вещества, в которых атомы металлов соединены с одной или несколькими гидроксидными группами (OH-). С точки зрения теории электролитической диссоциации, основания – это сложные вещества, при диссоциации которых в водном растворе образуются катионы металла (или NH4+) и гидроксид − анионы OH-). Амфотерные основания могут проявлять свойства слабых кислот.
6
ОСНОВАНИЯ
РАСТВОРИМЫЕ (ЩЕЛОЧИ)
NaOH ; Ca(OH)2
НЕРАСТВОРИМЫЕ
Fe(OH)2;Cu(OH)2
АМФОТЕРНЫЕ
Al(OH)3; Zn(OH)2


Рис. 1.2. Классификация
1.2. ОКСИДЫ
Оксиды − это сложные вещества, состоящие из двух элементов, один из которых кислород.

Рис. 1.3. Классификация
В качестве гидратов (соединений с водой) основным оксидам соответствуют основания, кислотным – кислоты, амфотерным – и те и другие.
1.3. КИСЛОТЫ
Кислоты − сложные вещества, состоящие из атомов водорода и кислотного остатка.
По теории электролитической диссоциации кислоты − это электролиты, которые при диссоциации в качестве катионов образуют только H+ (Н3О+). По составу: бескислородные и кислородсодержащие.
По числу атомов водорода, способных замещаться на металл: одно-, двух- и трёхосновные.
7
КИСЛОТЫ
БЕСКИСЛОРОДНЫЕ
КИСЛОРОДСОДЕРЖАЩИЕ
HCl – одноосновная
HBr – одноосновная
HI – одноосновная
H2S – двухоосновная
HNO3 – одноосновная
H2SO4 – двухосновная
H2CO3 – двухосновная
H2SiO3 – двухосновная
Рис. 1.4. Классификация
