
- •А.Л.Галкин, в.К.Османов химия
- •Isbn 978-5-502-00158-8 © нгту им. Р.Е. Алексеева, 2013
- •Введение
- •Классификация неорганических веществ
- •Аллотропия
- •1.4 Соли
- •Комплексные соли
- •Генетическая связь между различными классами соединений
- •Основание Кислота Примеры
- •Основные понятия и законы химии
- •Закон сохранения массы
- •Закон постоянства состава
- •Закон эквивалентов
- •Закон авогадро
- •Уравнение состояния идеального газа
- •3. Строение атома
- •3.1. Квантовые числа
- •3.2. Принципы заполнения атомных орбиталей
- •3.3. Полная электронная формула атома
- •3.4. Периодический закон элементов д. И. Менделеева
- •Физический смысл химической периодичности
- •4. Химическая связь и строение молекул
- •4.1. Физические основы образования молекул
- •4.2. Метод валентных связей (метод вс)
- •Значения длины и энергии связи у галогеноводородных кислот
- •Взаимосвязь кратности, длины и энергии связи с - с, с - о и n - n
- •Одна s-орбиталь и одна p-орбиталь превращаются в две одинаковые «гибридные» орбитали, угол между осями которых равен 180°:
- •4.3. Метод молекулярных орбиталей
- •Энергия, длина и порядок связи в молекулах элементов I периода
- •4.4. Металлическая связь
- •4.5. Межмолекулярные взаимодействия
- •5. Энергетика и направление химических процесов
- •5.1. Термодинамическая система и ее состояния
- •5.2. Изменение свойств термодинамической системы
- •5.3. Энергия, работа, теплота
- •5.4. Обратимые и необратимые процессы
- •5.5. Первый закон термодинамики
- •5.6. Направление химических реакций
- •Второй закон термодинамики
- •Постулат планка (третий закон термодинамики)
- •6. Скорость химических реакций и и химическое равновесие
- •6.1. Влияние концентрации реагентов на скорость реакции
- •6.2. Влияние температуры на скорость реакции
- •6.3. Влияние катализатора на скорость реакции
- •А) без катализатора и б) в присутствии катализатора
- •6.4. Скорость гетерогенных химических реакций
- •6.5. Химическое равновесие
- •6.5.1. Влияние внешних факторов на состояние равновесия
- •7. Растворы
- •7.1. Вода
- •Вода в природе
- •7.2. Образование растворов
- •7.3. Способы выражения концентраций растворов
- •7.4. Растворы электролитов
- •7.4.2. Равновесные процессы в растворах электролитов
- •Цвета кислотно-основных индикаторов в зависимости от рН раствора
- •8. Окислительно – восстановительные реакции
- •8.1. Степень окисления
- •8.2. Типичные окислители и восстановители
- •8.3. Классификация окислительно-восстановительных реакций
- •8.4. Составление уравнений окислительно-восстановительных реакций
- •9. Основы электрохимических процессов
- •9.1. Измерение стандартных электродных потенциалов
- •9.2. Направление окислительно-восстановительных реакций
- •9.3. Влияние внешних факторов на величину электродного потенциала
- •9.4. Законы фарадея
- •9.5. Элементы технической электрохимии
- •10. Коррозионные процессы
- •10.1. Электрохимическая коррозия
- •10.2. Кинетика коррозионных процессов
- •10.3.Методы защиты металлов от коррозии
- •11. Номенклатура и классификация органических соединений
- •11.1. Номенклатура органических соединений
- •11. 2. Классификация органических соединений по номенклатуре июпак
- •12. Высокомолекулярные соединения
- •12.1. Классификация высокомолекулярных соединений
- •12.1.1. Классификация высокомолекулярных соединений по структуре макромолекул
- •12.1.2. Классификация полимеров по поведению при нагревании
- •12.2. Сополимеры
- •12.3. Синтез высокомолекулярных соединений
- •12.4. Свойства полимеров
- •12.5. Важнейшие полимерные материалы
- •Примеры решения задач
- •1.Основные понятия и законы химии
- •Строение атома
- •Химическая связь и строение молекул
- •Задача 4.
- •Молекула bf3 . Электронная формула атома бора 5b - 2s22p1. При образовании трех -связей атом бора переходит в возбужденное состояние
- •Решение. Последовательность действий для предсказания геометрии молекул на основании теории локализованных электронных пар следующая:
- •1.Подсчитывают число валентных электронов молекулы или иона и записывают электронную валентную структуру (льюисову структуру);
- •2.По валентной структуре определяют число -связывающих и несвязывающих электронных пар, т.Е. Тип молекулы aBnEm (n – число - связей, m – число несвязывающих электронных пар);
- •Энергетика и направление химических процессов
- •4 Моль н2 – - 150,8 кДж
- •Скорость химических реакций и химическое равновесие Задача 1
- •Растворы Примеры решения задач
- •Окислительно-восстановительные реакции примеры решения типовых задач
- •Основы электрохимических процессов
- •Коррозионные процессы
- •Галкин Андрей Львович Османов Владимир Кимович
- •603950, Нижний Новгород, ул.Минина, 24.
5.2. Изменение свойств термодинамической системы
Пусть некоторая газовая система находится в состоянии 1 и характеризуется некоторыми значениями V1, P1, T1. Оказывая на систему какое-либо воздействие, т.е. изменяя значение этих свойств, мы можем перевести систему в состояние 2 с параметрами V2, P2, T2 по пути 1абс2, либо по пути 1д 2.
2
2

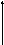
V2, P2, T2 V2, P2, T2
б
с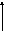

1
а 1
д 

V1, P1, T1 V1, P1, T1
Эти пути в общем случае называются путями изменения системы, а в химии - пути реакции. Оказывается, что изменение свойств системы при переходе из состояния 1 в состояние 2 определяется только этими состояниями и не зависит от пути, т.е. V=V2-V1, P=P2-Р1, Т = Т2 – Т1. В самом деле, неважно, в каком порядке мы проводим сжатие, расширение или нагрев системы, важно, какими они стали в результате.
ЕСЛИ ИЗМЕНЕИЕ КАКОГО-ЛИБО ПАРАМЕТРА СИСТЕМЫ НЕ ЗАВИСИТ ОТ ПУТИ ПРЕВРАЩЕНИЙ, ТО ЭТОТ ПАРАМЕТР ЯВЛЯЕТСЯ СВОЙСТВОМ ТЕРМОДИНАМИЧЕСКОЙ СИСТЕМЫ (ФУНКЦИЕЙ СОСТОЯНИЯ).
В зависимости от постоянства того или иного параметра в термодинамике различают ИЗОТЕРМИЧЕСКИЕ ПРОЦЕССЫ – идут при постоянной температуре, ИЗОБАРИЧЕСКИЕ ПРОЦЕССЫ – идут при постоянном давлении,
46
ИЗОХОРИЧЕСКИЕ – при постоянном объеме. Процессы, в которых совершается работа, но при этом система не обменивается теплом с окружающей средой, называются АДИАБАТИЧЕСКИМИ.
5.3. Энергия, работа, теплота
Из всех видов энергии химическая термодинамика оперирует прежде всего с внутренней энергией системы – U (кДж). Запас внутренней энергии в системе определяется суммой кинетических энергий частиц и всех видов взаимодействий между частицами, образующими эту систему. Абсолютное значение внутренней энергии измерению не поддается, однако можно измерить ее изменение () относительно некоторого условного нулевого значения, оговоренного при стандартных условиях (ст.усл.), за которые в термодинамике принята температура 298 К (250С) и давление 101325 Па (1атм). Считается, что если в ходе какого-либо процесса внутренняя энергия возрастает, то U – величина положительная, если убывает- то отрицательная. Внутренняя энергия системы является ее свойством, т.е. не зависит от пути реакции, а определяется только разностью энергий начального и конечного состояний.
В ходе химических превращений энергия может передаваться от одной системы к другой в виде теплоты Q, работы А против внешних сил, действующих на систему, либо в виде различного вида излучений. Теплота и работа имеют размерность энергии, но далеко не однозначны с ней. И та и другая являются мерами энергии или формами ее передачи, но не являются свойствами системы, т.е. нельзя говорить о том, что они запасены в веществе. Говоря о работе мы всегда имеем в виду некоторый процесс, который одна система совершает над другой. Газ, расширяясь в цилиндре с поршнем, может сжать пружину и тем самым передать ей часть своей энергии. Следовательно, работа является одной из форм передачи энергии и носит макроскопический характер.
Второй формой передачи энергии является теплота, которую также нельзя рассматривать как запас свойства в веществе. Понятие теплоты часто отождествляют с запасом кинетической энергии частиц вещества. Однако это не совсем верно. Так, например, теплота, отдаваемая при конденсации пара, образуется в основном за счет уменьшения потенциальной энергии взаимодействия молекул. При передаче энергии в виде теплоты система получает ее в микромолекулярной форме, т.е. в виде изменения энергии взаимодействия частиц и энергии их движения.
Подытоживая, можно сказать, что работа является макрофизической формой передачи энергии, а теплота - микрофизической.
