
Конспект лекций по общей физики (1-4 семестр)
.pdf


317
|
|
|
|
|
Таблица 40.4 |
|
|
|
|
|
|
|
|
Спектроскопическое |
|
|
|
|
|
|
обозначение |
n |
l |
m |
s |
|
Подоболочка |
оболочки |
|
|
|
|
|
|
K |
1 |
0 |
0 |
↑↓ |
|
1s |
|
|
0 |
0 |
↑↓ |
|
2s |
L |
2 |
|
–1 |
↑↓ |
|
|
1 |
0 |
↑↓ |
|
2p |
||
|
|
|
||||
|
|
|
1 |
↑↓ |
|
|
|
|
0 |
0 |
↑↓ |
|
3s |
|
|
|
–1 |
↑↓ |
|
|
|
|
1 |
0 |
↑↓ |
|
3p |
|
|
|
1 |
↑↓ |
|
|
M |
3 |
|
–2 |
↑↓ |
|
|
|
|
|
–1 |
↑↓ |
|
|
|
|
2 |
0 |
↑↓ |
|
3d |
|
|
|
1 |
↑↓ |
|
|
|
|
|
2 |
↑↓ |
|
|
5.8. Спонтанное и вынужденное излучение. Лазеры
5.8.1. Время жизни состояния
Стационарным (т. е. сколь угодно долго живущим) является только основное состояние атома (это релятивистский эффект).
Время жизни возбуждённого состояния – время, за которое число атомов, находящихся в данном возбуждённом состоянии, уменьшается в e раз.
Для возбуждённого состояния время жизни |
τ ~ 10–1 с; |
для возбуждённого метастабильного состояния |
τ ~ 10–1 с; |
для невозбуждённого (основного) состояния |
τ → ∞. |
318 |
|
Лекция 41 |
|
5.8.2. Спонтанное и вынужденное излучение |
|
Излучение |
|
спонтанное |
вынужденное |
(самопроизвольное) |
(индуцированное) |
Спонтанные переходы всегда происходят сверху вниз (т. е. энергия атома уменьшается и излучается фотон).
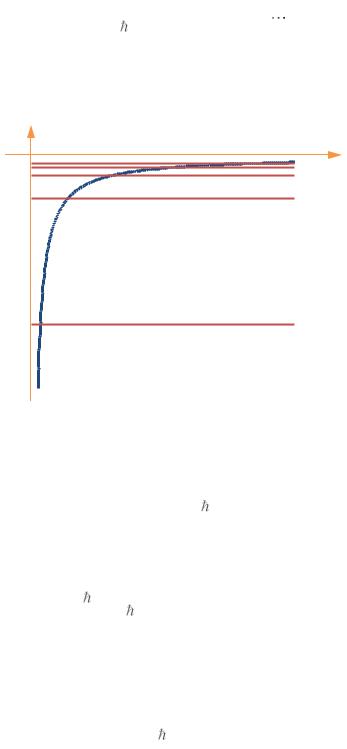
Коэффициент спонтанного излучения Amn – вероятность спонтанного перехода атома из состояния m в состояние n (m > n).
Если в состоянии m находится Nm атомов, то за время dt в состояние n перейдёт
dNm AmnNmdt Nm N0me |
A t |
, |
|
mn |
|||
|
|
где N0m – число атомов в состоянии m в начальный момент времени (t = 0). При
N |
e |
1 |
t = τ – время жизни состояния m, Amnt 1 |
|
m |
, |
|||
N |
|
|||
|
|
|
|
|
0m |
|
|
|
|
A |
|
1 |
. |
|
|||
mn |
|
τ |
|
|
|
|
Коэффициент вынужденного излучения Bmn – вероятность вынужденного пе-
рехода атома из состояния m в состояние n; коэффициент вынужденного поглощения Bnm – вероятность вынужденного перехода атома из состояния n в состояние m;
B |
B |
. |
mn |
nm |
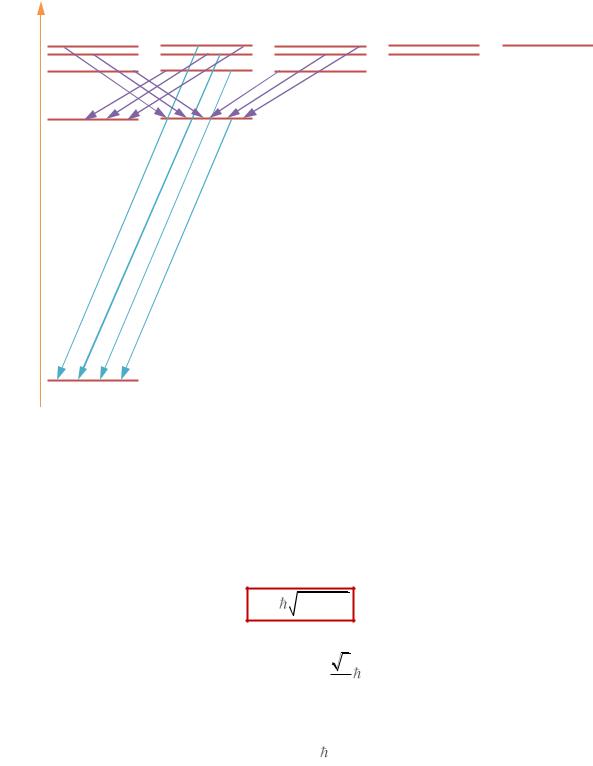
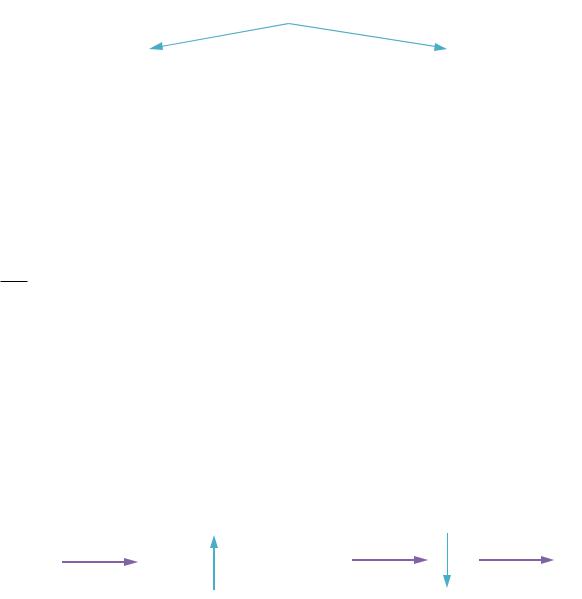
Схемы вынужденных переходов представлены на РИС. 41.1А, Б.
Amn, Bmn, Bnm – коэффициенты Эйнштейна.
а |
m |
|
а |
m |
|
|
б |
|
Bnm |
Bmn |
|||||||
|
|
|||||||
|
|
|
|
|
|
|
||
|
n |
|
|
n |
|
|
|
|
|
|
|
|
|
||||
|
Вынужденное излучение |
|
Вынужденное поглощение |
|
||||
|
|
а |
|
|
б |
|
||
Рис. 41.1
На РИС. 41.1Б волна а когерентна волне б.
5.8.3. Двухуровневая система
Пусть пучок света проходит через вещество, атомы которого могут находиться в двух состояниях: m и n. Падающий свет будет вызывать два процесса: переходы сверху вниз и снизу вверх. Первый процесс ведёт к усилению света, второй – к ослаблению.
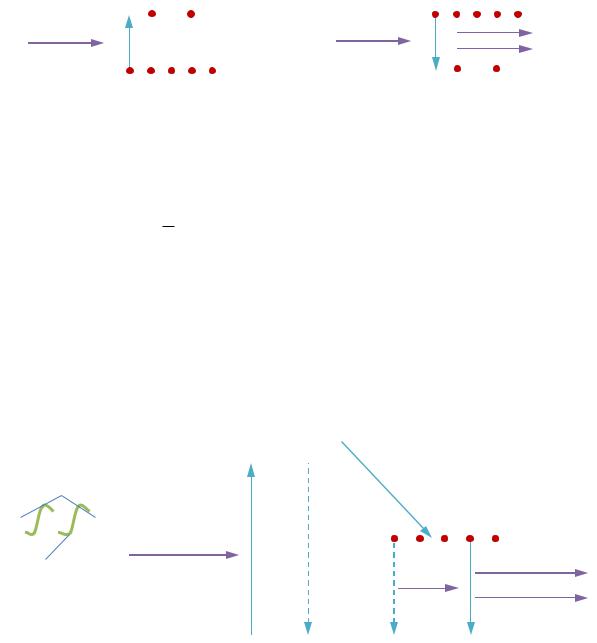
В ТАБЛИЦЕ 41.1 представлены две возможные ситуации заполнения уровней m и n: обычная и инверсная заселённость.
319
|
|
|
|
|
|
|
|
Таблица 41.1 |
|
|
N N |
|
|
|
|
N |
N |
||
|
|
|
|
|
|||||
|
m |
n |
|
|
|
m |
n |
||
Обычная населённость |
Инверсная населённость |
||||||||
|
|
|
|
|
m |
|
|
|
m |
|
|
|
|
|
|
|
|
||
|
|
|
|
|
n |
|
|
|
n |
|
|
|
|
|
|
|
|
||
Число актов поглощения больше числа |
Число актов излучения больше числа |
||||||||
актов излучения. |
|
|
|
|
актов излучения. |
|
|
||
Свет поглощается. |
|
|
|
|
Свет усиливается. |
|
|
||
Это естественная ситуация. Заселён- |
Это искусственная ситуация (T < 0). |
||||||||
ность уровней по распределению Боль- |
|
|
|
|
|||||
цмана |
|
|
|
|
|
|
|
|
|
|
|
|
hν |
|
|
|
|
|
|
|
N N0e |
kT |
. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
5.8.4. Оптический квантовый генератор (лазер)
1. Рубиновый лазер
Рабочее тело – корунд (Al2O3) с примесью 0,03-0,05% хрома (Cr2O3) – рубин. На торцы рубинового стержня нанесено зеркальное напыление, они образуют параллельные зеркала, пропускающие 8% света (РИС. 41.2). Пространство между зеркалами играет роль резонатора. Источник энергии – импульсная ксеноновая лампа (с её помощью происходит оптическая накачка рубина).
|
|
|
|
|
|
Полоса уровней |
|
|
||
|
|
|
|
3 |
|
τ ~ 10–8 с |
|
|
|
|
|
зеркала |
|
|
|
|
|
|
A32 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
A31 |
|
|
Метастабильный |
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
2 |
|
уровень |
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
зелёный |
|
|
τ ~ 10 c |
||||
|
|
|
|
|
|
|||||
ксеноновая |
|
λ13 |
= 5600 Å |
A21 |
B21 |
|||||
|
лампа |
|
красный |
|||||||
|
|
|
|
|
B13 |
|
|
|||
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
λ21 = 6943 Å |
|
|
|
|
|
1 |
|
|
|
|
|
|
|
Рис. 41.2 |
|
|
|
|
Рис. 41.3 |
|
|
||
|
|
|
|
|
|
|
|
|||
Схема энергетических уровней рубина показана на РИС. 41.3.
При накачке ионы Cr3+ переходят из основного состояния 1 в возбуждённое состояние 3. Время жизни этого состояния мало. Так как A32 > A31, большая часть электронов переходит в состояние 2 (время жизни около 10–1 с). Создаётся инверсная заселённость уровней 2 и 1. Электрон может перейти с уровня 2 на уровень 1 (сверху вниз, A21) с излучением фотона. Этот фотон может вызвать вынужденное излучение (B21). Фотоны, двигаясь между зеркальными торцами, создают эффект лавины.



 l l
l l  серия Бальмера
серия Бальмера серия Лаймана
серия Лаймана
 s s
s s 
 j j
j j  l
l .
.