
- •Х и м и я
- •Введение
- •Часть 1. Общая и неорганическая химия
- •1.1 Основные понятия и законы химии. Простейшая и истинная формула вещества. Массовая доля элемента в веществе
- •1.2 Строение атома. Периодический закон и
- •Периодическая система элементов д.И.Менделеева.
- •Характер изменения свойств элементов и их
- •Соединений по периодам, группам и подгруппам
- •1.3 Химическая связь и строение молекул. Валентность и
- •1.4 Закономерности течения химических реакций
- •1.5 Основные классы неорганических соединений
- •1.6 Растворы. Электролитическая диссоциация.
- •1.7 Окислительно-восстановительные реакции. Электрохимические процессы
- •Часть 2 органическая химия
- •2.1 Основные представления в органической химии
- •2.2 Алканы, циклоалканы
- •2.3 Алкены, алкадиены
- •2.4 Алкины
- •2.5 Галогенпроизводные углеводородов жирного ряда
- •2.6 Спирты, простые эфиры
- •2.7 Альдегиды и кетоны
- •2.8 Карбоновые кислоты и их производные
- •2.9 Амины, аминокислоты, белки
- •2.10 Ароматические углеводороды, их галоген-,
- •10 Заместители II рода находятся в ряду:
- •Нуклеофильным реагентом является:
- •Бромированием сульфобензолаполучают:
- •2.11 Фенолы. Ароматические амины, альдегиды, кетоны и кислоты
- •Количество гидроксильных групп соединения но он ,
- •2.12 Углеводы
- •2.13 Гетероциклические соединения
- •Часть 3. Физика и химия полимеров
- •3.1 Общие вопросы фхп, классификация полимеров
- •22 Необходимость определения средней молекулярной массы полимеров вызвана их:
- •3.2 Методы получения полимеров
- •3.3 Химические реакции полимеров
- •3.4 Структура и физико-механические свойства
- •9 Переход высококристаллического полимера в вязкотекучее состояние
- •11 При образовании и удлинении шейки в образце стеклообразного полимера
- •12 При охлаждении полимера ниже температуры хрупкости невозможно
- •Причиной ползучести полимера под действием постоянной нагрузки
- •Прочность полимерных волокон или пленок при вытягивании повышается при прохождении процессов:
- •3.5 Растворы полимеров. Пластификация.
- •Библиографический список
- •346500, Г. Шахты, Ростовская область, ул. Шевченко, 147.
1.4 Закономерности течения химических реакций
1 Скорость экзотермической реакции с понижением температуры:
1) повышается; 2) не изменяется; 3) понижается.
2 Скорость экзотермической реакции с увеличением температуры:
1) повышается; 2) понижается; 3) не изменяется.
3 Скорость эндотермической реакции с понижением температуры:
1) повышается; 2) понижается; 3) не изменяется.
4 Скорость эндотермической реакции с увеличением температуры:
1) повышается; 2) понижается; 3) не изменяется.
5 Понижение давления сместит равновесие в системе
PCl5(г) PCl3(г) + Сl2(г):
1) вправо; 2) влево; 3) не сместит.
6 Повышение давления сместит равновесие в системе
Н2(г) + Сl2(г) 2HCl (г):
1) вправо; 2) влево; 3) не сместит.
Понижение температуры в системе СН4(г) + СО2(г) 2 СО(г) + 2Н2(г),
Н0 сместит равновесие :
1) влево; 2) вправо; 3) не сместит.
8 Повышение температуры сместит равновесие в системе
2SO2(г) + О2 (г) 2SO3 (ж); :
1) влево; 2) вправо; 3) не сместит.
9 Гомогенной является система:
1) СаСО3 = СаО + СО2; 2) СО2 + С = 2 СО;
3) 2СО + О2 = 2СО2; 4) С + О2 = СО2.
10 Гетерогенной является система:
1) 2НBr H2 + Br2; 2) 4 H2O + 3Fe 4Н2 + Fe3O4;
3) N2O4 2 NO2; 4) 2 CO + O2 2 CO2.
11 Выражение скорости прямой реакции для системы
2Cr + 3Cl2 = 2 CrCl3 имеет вид:
1) V= k [ Cl2]3; 2) V = k [Cl2];
3) V = k[Cr] [Cl2]3; 4) V=k[Cr] [3Cl2].
Равновесие в системе 2СО СО2 + С сместится вправо, если концентрацию
СО:
1) понизить; 2) повысить; 3) не изменять.
13 Повышение температуры сместит равновесие в системе
2SO2 + O2 2 SO3, :
1) вправо; 2) влево; 3) не сместит.
14 Скорость реакции зависит от концентрации одного из реагирующих
веществ:
1) 2SO2(г) + O2(г) 2SO3(ж) ; 2) SO2(г) + H2O(г) H2SO3(ж);
3) S(т) + О2(г) SO2(г); 4) N2(г) + 3H2(г) 2NH3(г).
Равновесие в системе 2NO(г) + О2 2NO2(г) сместится в сторону
обратной реакции, если давление:
1) повысить; 2) понизить; 3) не изменять.
Равновесие в системе 2NH3(г) N2 (г) + 3Н2(г) сместится в сторону прямой реакции, если концентрацию N2:
1) понизить; 2) повысить; 3) не изменять.
Скорость прямой реакции будет зависит от концентрации обоих
взаимодействующих веществ в реакции:
1) С(т) + О2(г) СО2 (г); 2) 2СО (г) + О2 2 СО2(г);
3) СО2(г) + 2С(т) 2СО(г); 4) Н2О(пар) + С Н2 + СО.
18 Повышение давления сместит равновесие в системе
N2(г) + О2(г) 2 NO(г):
1) вправо; 2) влево; 3) не сместит.
Равновесие в системе 2СО(г) СО2(г) + С(т) сместится в сторону прямой
реакции, если концентрацию СО2:
1) уменьшить; 2) увеличить; 3) не изменять.
20 Гомогенным катализом является:
1)
2 SO2
+ O2
![]() 2SO3;
2SO3;
2)
2 SO2
+ O2
![]() 2
SO3;
2
SO3;
3)
N2
+ 3H2
![]() 2
NH3;
2
NH3;
4)
HCOOH![]() CO2
+ H2.
CO2
+ H2.
Скорость химической реакции 2NO + O2 2NO2 c увеличением
концентрации NO в 3 раза:
1) возрастет в 27 раз; 2) возрастет в 9 раз;
3) уменьшится в 27 раз; 4) уменьшится в 9 раз.
22 Константа равновесия для системы 4 Н2O + 3 Fe 4H2 + Fe3O4 имеет вид:
1) [H2] [Fe3O4]; 2) [H2]4 ; 3) [4H2]; 4) [H2O]4 .
[H2O] 4 [Fe]4 [H2O]4 [4H2O] [H2]4
Для системы 4HCl(г) + О2(г) 2Н2О(г) + 2Сl2(г) константа равновесия
имеет вид:
1)
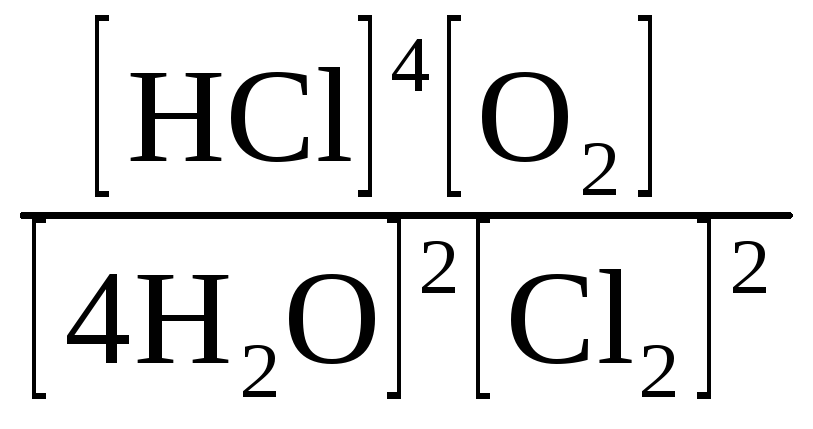 ; 2)
; 2) ;
;
3)
 ; 4)
; 4) .
.
24 Выражение Vпр= k[O2] соответствует реакции:
1) С + О2 = СО2; 2) N2 + O2 = 2NO;
3) 2H2 + O2 = 2H2O; 4) N2 + 2O2 = 2NO2.
25 Зависимость скорости реакции от температуры выражается формулой:
1)
![]() ; 2)
; 2)![]() ;
3)V
= k
[A]n[B]m;
4)
;
3)V
= k
[A]n[B]m;
4)
![]() .
.
26 Математическим выражением закона действующих масс является:
1)
![]() ; 2)
; 2)![]() ;
;
3)
V = k [A]n[B]m; 4)
![]() .
.
Увеличение давления в 2 раза в системе СаО + СО2 = СаСО3 изменит
скорость реакции:
1) увеличит в 2 раза; 2) уменьшит в 2 раза;
3) не изменит; 4) увеличит в 4 раза.
28 Равновесие в системе 2SO2(г) + О2(г) 2SO3(ж), сместится влево
при:
1) уменьшении давления, увеличении температуры;
2) уменьшении давления, уменьшении температуры;
3) увеличении давления, уменьшении температуры;
4) увеличении давления, увеличении температуры.
29 Выражение Vпр = k[H2] соответствует реакции:
1) СО(г) + 2Н2(г) СН3ОН(ж);
2) CuO(тв) + Н2(г) Сu(т) + Н2О (пар);
3) 2 Н2 (г) + О2 (г) 2 Н2О (пар);
4) N2(г) + 3Н2(г) 2 NH3(г).
30 Равновесие системы PCl3(г) + Сl2(г) PCl5(г), , сместится в сторону
прямой реакции, если:
1) понизить температуру, увеличить давление;
2) повысить температуру, увеличить давление;
3) уменьшить давление, понизить температуру;
4) повысить температуру, уменьшить давление.
31 Скорость прямой реакции для системы
Fe2O3(т) +3H2(г) 2Fe(т) + 3Н2О(пар) выражается уравнением:
1) V = k [Fe2O3] [H2]3; 2) V = k [H2]3;
3) V = k [Fe]2 [H2O]3; 4) V = k [H2O]3.
32 Для системы Н2О(г) + СО(г) СО2(г) + Н2(г) константа равновесия имеет
вид:
1)
![]() ; 2)
; 2)![]() ;
3)
;
3)![]() ; 4)
; 4)![]() .
.
Повышение давления сместит равновесие в сторону прямой реакции в
системе:
1) 2 Н2О(г) 2Н2(г) + О2(г) ;
2) СаСО3(тв) СаО(тв) + СО2;
3) N2(г) + 3Н2 (г) 2NH3(г);
4) СО(г) + Н2О СО2 (г) + Н2(г).
Увеличение давления в 2 раза в системе S(т) + О2(г) SO2(г) изменит
скорость реакции:
1) увеличит в 2 раза; 2) увеличит в 4 раза;
3) не изменит; 4) уменьшит в 2 раза.
Равновесие в системе N2(г) + 3Н2(г) 2 NH3(г), 0 0, сместится в
сторону обратной реакции при:
1) увеличении температуры, уменьшении давления;
2) уменьшении температуры, уменьшении давления;
3) уменьшении температуры, увеличении давления;
4) увеличении температуры, увеличении давления.
Изменение энтропии (S) в реакции 2Н2О(пар) = 2Н2(г) + О2(г) имеет
значение:
1) больше нуля; 2) меньше нуля; 3) равно нулю.
37 Росту энтропии способствует:
1) увеличение температуры, увеличение давления;
2) уменьшение температуры, увеличение давления;
3) увеличение температуры, уменьшение давления;
4) уменьшение температуры, уменьшение давления.
38 Изменение энтропии (S) в реакции N2 + 3H2 = 2 NH3 имеет значение:
1) больше нуля; 2) меньше нуля; 3) равно нулю.
Самопроизвольно протекает реакция, для которой энергия Гиббса (G)
имеет значение:
1) больше нуля; 2) меньше нуля; 3) равно нулю.
40 При переходе от Н2О(тв)Н2О(ж)Н2О(газ) энтропия:
1) увеличивается; 2) уменьшается; 3) не изменяется.
