
Климанов Радиобиологическое и дозиметрическое планиров. Ч.1 2011
.pdf10.ICRU. Prescribing, recording and reporting photon beam therapy
/Report 50. 1993. Bethesda, Maryland, U.S.A.
11.ICRU. Prescribing, recording and reporting photon beam therapy (supplement to ICRU Report 50) / Report 62. 1999 Bethesda, Maryland, U.S.A..
12.The value of non-uniform margins for six field conformal irradiation of localized prostate cancer / B. Picett, III Roach, M. Verhey et al. // Int. J. Radiat. Oncol. Biol. Phys. V.32. 1995. P. 211 – 218.
13.Uncertainties in CT-based radiation therapy treatment planning associated with patient breathing / J.M. Balter, R.K. Ten Haken, T.S. Lawrence et al // Int. J. Radiat. Oncol. Biol. Phys. V.36. 1996. P. 167 –
174.
14.British Institute of Radiology. Geometric uncertainties. 2003. London.
241
Глава 4. Данные пациента, поправки, позиционирование
1.Введение
Всвоей известной статье 1993 года [1] Блэл и Велч объявили: ―За последние две декады разнообразное новое оснащение техники
иметодов диагностики революционизировали практику медици-
ны‖. Спустя семнадцать лет это заявление стало еще более актуальным. Однако в разделе, названном ―The cycle of Increase Intervention,‖ авторы статьи предупреждают о возможности неправиль-
ного восприятия степени распространения злокачественного новообразования и терапевтической эффективности, базирующейся на
улучшенных технологиях формирования изображений и визуализации в медицине (англ. imaging), и о серьезном риске дальнейше-
го нарастания круга медицинского вмешательства. В этой главе термин ―визуализация‖ используется в обобщенном смысле, под которым понимаются не только получение медицинских изображений, но и разнообразные медицинские исследования, направленные на изучение типа опухоли, ее агрессивности, геометрических параметров, распространения метастазов и др. Новые технологии визуализации могут отвлечь радиационных онкологов от ответа на главный вопрос: «Как лечить пациента, у которого недавно обнаружена субклиническая форма заболевания?» Другими словами, способна ли ранняя визуализация отличить вяло текущее заболевание от его агрессивной формы? Некоторые формы рака развиваются очень медленно и могут не повлиять заметно на пациента в течение оставшегося периода жизни.
К счастью, визуализация за последние десятилетия также достигла существенного прогресса в анализе гетерогенности опухоли и ее метаболизма. Ее роль больше не ограничивается обнаружением, определением стадии и наблюдением за опухолью после куративного лечения, но и стала включать корректировку и мониторинг ответной реакции на терапию.
Традиционные специфичные по локализации режимы облучения, учитывающие, в основном, только стадию опухоли, заменяются в настоящее время на индивидуализированные и мишенные
242
подходы, учитывающие индивидуальные характеристики опухоли. Современные технологии облучения пучками сложной формы в 3М КТЛ и особенно ЛТМИ, по всей видимости, превышают наши возможности по локализации опухолей и нормальных тканей при использовании традиционных методах визуализации. Применяя ЛТМИ, можно подводить предписанные дозы к нескольким мишенным объемам, обеспечивая высокий дозовый градиент между опухолью и нормальной тканью. Исследования эскалации дозы, инициируемые представлением, что неоднородность дозы внутри PTV может привести к повышению локального контроля, способствовали росту интереса к более точному морфологическому и биологическому очерчиванию объема мишени.
Все возрастает роль визуализации в обеспечении неинвазивных объективных средств измерения ответной реакции опухоли на комплексное лечение, в том числе и с использованием «молекулярной медицины». На рис. 4.1 суммируются различные роли, которые играет визуализация в ЛТ.
2. Классификация рака
Одним из ключевых факторов, влияющих на принятие решения в онкологии, является корректная классификация рака, основанная на анатомических и гистологических показателях. Описания подобные таким, как ранний, умеренный или продвинутый рак, в лучшем случае бессмысленны. Национальные и международные организации многие годы пытались навести некоторый порядок и всеобщий консенсус в эту классификацию. Хотя в литературе время от времени появляются разные варианты классификации рака, большинство из них не получило широкого распространения в клинической практике. Пригодная для работы классификация должна иметь следующие характеристики:
быть полезной для клиницистов при принятии решений;
иметь прогностическое значение;
помогать в оценке результатов лечения;
иметь легкость в обмене информацией;
помогать в продолжающихся исследованиях рака.
243

Рис.4.1. Обзор различных функций, которые выполняет визуализация в ЛТ. Здесь: PRV – планируемый объем органа риска; MRI – магнитная резонансная томография; US – ультразвуковое обследование; EPID – электронное портальное устройство для получения изображений; DCE – динамическое усиление контраста; MRS
– магнитная резонансная спектроскопия; PET – позитронная эмиссионная томография; SPECT – однофотонная эмиссионная компьютерная томография [2]
244
В настоящее время наибольшее распространение получили две классификации, разработанные наиболее авторитетными организациями UICC (Международный антираковый институт) [3] и AJCC (Американский объединенный комитет раковой стадии) [4].
Гистопатологическая классификация. В дополнение к широко используемым морфологическим характеристикам последние новшества в гистохимической, иммунохимической и электромикроскопической информации сделали эту область гистопатологической классификации более комплексной и определенно более точной. Хотя интрапатологические и интерпатологические расхождения во мнениях всегда существуют, по большинству случаев наблюдается общее согласие.
Второй важный аспект гистологической классификации заключается в градации рака. Градация означает выражение степени злокачественности рака. Обычно устанавливается I градация (хорошая дифференциация), II градация (умеренно хорошая дифференциация) и III градация (плохая дифференциация). Градация играет важную прогностическую и терапевтическую роль, а в некоторых раках, таких как саркома, является частью стадирования.
Классификация стадии. Анатомическая стадия означает просто количественную протяженность поражения. После введения системы метастазирования злокачественных узлов в литературе за последние 50 лет появились различные варианты этой классификации. До 1982 г. имелось две отдельных анатомических классификации, одна UICC и вторая AJCC. Чтобы унифицировать терминологию, в 1982 г. международные комитеты согласились на единообразную систему стадирования [4]. Она имеет три компонента: T
– для первичного или прямого распространения, N – для вторичного или лимфатического поражения и M – для сосудистого распространения или удаленных метастазов. Различные подкатегории T, T1, T2, T3 и T4 описывают растущую протяженность первичной опухоли. Развивающееся заболевание узлов классифицируется N0 (нет клинических признаков вовлечения региональных лимфатических узлов), N1,N2 и N3 обозначают различные градации заболевания узлов. Присутствие или отсутствие метастазов выражается через M0 или M+. Комбинация T,N, и M определяет различные стадии болезни.
245
3. Планирование лучевого лечения
3.1. Принятие решения
Основным принципом в терапии декларируется излечение пациента с минимальными функциональными и структурными расстройствами. Процесс принятия решения относительно способов лечения онкологического больного является очень сложным. Он включает учет особенностей опухоли (гистопатологический тип и анатомическая протяженность), персональных факторов (физическое и психологическое состояние), эмоционального статуса пациента, а иногда и его близких. В этом процессе всегда участвуют разные специалисты, имеющие опыт в данной области, такие как хирург, радиационный онколог, медицинский онколог, патологоанатом, радиолог (рентгенолог) и работник сферы социального обеспечения или страхования. В результате обсуждения команда приходит к согласованному заключению, наилучшему с точки зрения интересов пациента. Первый шаг в этом решении, учитывающем все факторы, заключается в том, будет ли лечение иметь куративный потенциал или будет чисто паллиативным. Вторым шагом является решение, какой способ лечения (хирургия, лучевая терапия, химиотерапия или комбинация разных способов) имеет наибольшие шансы достичь цели при минимальных функциональных и анатомических нарушениях.
3.2. Процесс планирования лучевого лечения
Процесс планирования лучевого лечения представляет очень
сложную процедуру, который требует наличия следующих составляющих [5]:
всестороннее знание природной истории данной опухолевой патологии;
точные данные об истинной протяженности опухоли (стадии);
знание объемной толерантности нормальных тканей к облучению, особенно тканей, прилежащих к опухоли, и их функционального и физиологического статуса;
246
решение относительно цели ЛТ, является ли она радикаль-
ной, адъювантной или паллиативной и используемой модальности (только ЛТ или комбинация с хирургией и/или с химиотерапией);
планирование физических аспектов лечения, включающие
точное оконтуривание объема мишени и структур нормальных тканей, определение и конструкцию портов облучения;
расчет дозовых распределений внутри выделенных объемов
ипостроение объемных изодозовых поверхностей и изодозовых кривых;
методика воспроизводимого позиционирования и иммобилизации пациента при симуляции и ежедневного облучения;
верификация процедур для обеспечения гарантии качества по всему курсу ЛТ.
При использовании ЛТМИ задачи, решаемые медицинскими физиками и радиационными онкологами, еще более усложняются,
так как повышаются требования к точности обратного и прямого планирования и к реализации плана облучения.
4.Получение данных о пациенте
4.1. Введение
Точное планирование возможно только при наличии достаточных данных о пациенте. Такие данные включают контур тела, очертания, взаимное расположение и плотность важных внутренних структур, местоположение и протяженность объема мишени и т.д.
Тип и детальность требуемой информации о пациенте существенно зависят от вида создаваемого плана облучения. Упрощенно все планирование можно разделить на 2-мерное и 3-мерное (2D и 3D в англоязычной литературе). Для их выполнения необходимы данные о пациенте. При 2-мерном планировании:
•контур пациента, полученный с помощью какого-либо устройства и нарисованный на планшете с указанием реперных (ссылочных) точек;
•симуляционные рентгенограммы для сравнения с пленочными измерениями во время облучения;
247
•при расчете нерегулярных полей могут идентифицироваться на симуляционной рентгенограмме наиболее важные точки (точки интереса) и определяться при симуляции глубины интереса;
•идентификация ОР и их глубин.
При 3-мерном планировании:
•массив данных от компьютерного томографа (КТ) области облучения с подходящими расстояниями между срезами (сканами);
•на каждом КТ срезе должен быть очерчен внешний контур тела пациента;
•на КТ срезах оконтуриваются объемы опухоли и мишени (делается радиационным онкологом);
•если проводится расчет ГДО, то полностью выделяются ОР и другие структуры (пример на рис.3.25 и 3.26);
•при создании объединенного изображения (fusion) требуются МРТ (магниторезонансная томография) и другие исследования;
•для сравнения с пленочными измерениями во время облучения используются симуляционные рентгенограммы или цифровая радиография.
4.2.Контур тела
Существует много устройств для определения контуров тела. Простейшее – свинцовая проволока в пластиковой оболочке.
Наиболее точным из механических устройств является пантограф, в котором для измерения внешнего контура используется специальный подвижный щуп, связанный с самописцем. В более поздних разработках применяются оптические и ультразвуковые методы. Наиболее универсальным устройством, определяющим как внешние контуры, так и внутреннюю структуру тела пациента, является компьютерный рентгеновский томограф (КТ). При определении контуров важно учитывать следующие моменты:
•контур необходимо измерять в той же позиции, в какой производится облучение, поэтому лучшее место для этого – стол симулятора;
•линия, представляющая плоскость стола, должна четко указываться в контуре для установки углов падения пучков;
•на контуре должны отмечаться метки костей и точки входа пучков;
248
•в ходе курса облучения необходима проверка контуров;
•при значительном изменении толщины тела в пределах поля облучения необходимо измерение контуров в нескольких плоскостях.
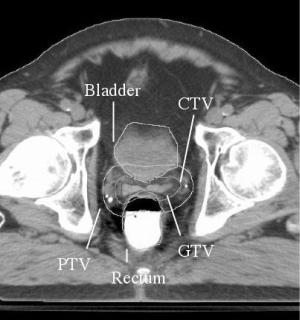
Рис. 4.2. Контуры GTV, CTV, PTV и органов риска (Bladder – мочевой пузырь и Rectum – прямая кишка) на срезе от КТ при планировании облучения простаты
4.3.Внутренние структуры
4.3.1.Рентгеновские исследования
Для получения данных о внутренних структурах применяются следующие устройства и методы: рентгенодиагностическая аппаратура, поперечная томография, компьютерная рентгеновская томография, ядерно-магнитный резонанс (ЯМР), ультразвук и позитронная томография. Изображения, получаемые в традиционной
249
рентгеновской диагностике, не выявляют многих мелких деталей так как:
•проектирование трехмерной анатомической информации на двумерный приемник затушевывает различия в прохождении X- лучей через трехмерные структуры тела;
•традиционные средства визуализации изображений в рентгенодиагностике (рентгеновские пленки, флуоресцентные экраны, усиливающие экраны) не способны разрешить разницу в интенсивности падающего на них излучения порядка нескольких процентов;
•широкие пучки X-лучей, применяемые при рентгенодиагностике, создают много рассеянного излучения, которое мешает выявлению мелких деталей.
4.3.2. Компьютерная томография
Отмеченные недостатки существенно смягчаются в современной рентгеновской компьютерной томографии (КТ). КТ следует признать золотым стандартом визуализации. Клиническое применение КТ в ЛТ началось в конце семидесятых годов прошлого века, а в настоящее время эти исследования пациентов приобрели в онкологических клиниках статус обязательных. Пример КТ изображения головы пациента приводится на рис. 4.2 и 4.3.
Медицинское изображение при КТ исследованиях получается достаточно быстро, поэтому различные артефакты, связанные с непроизвольными движениями пациентов, не создают серьезных проблем (исключением является грудная клетка). Изображение опухоли может быть улучшено с помощью введения рентгеноконтрастных йодированных соединений, что особенно важно при исследованиях центральной нервной системы. В целом, контраст для мягкой ткани является хорошим, что сочетается с высоким разрешением, так как размер вокселя может быть сделан очень малым. Контраст для кости также является превосходным, что позволяет диагностировать самое начало заболевания. В то же время небольшое дополнительное облучение не создает проблем для онкологических больных.
Реконструкция изображения в томографии представляет сложный математический процесс. В процессе реконструкции при КТ
250
