
Климанов Радиобиологическое и дозиметрическое планиров. Ч.1 2011
.pdfКонтрольную точку целесообразно выбирать в центре PTV или на пересечении центральных осей пучков.
МКРЕ вводит следующие понятия для значений дозы в объеме. Максимальная доза. Рекомендуется определять Dmax и внутри,
и снаружи PTV. Чтобы Dmax была клинически значима, она должна иметь место в некотором объеме, размеры которого не меньше 15 мм. Меньшие объемы в большинстве случаев не характеризуют толерантность нормальных тканей больших органов. Однако если органами риска являются глаза или оптический нерв, допускаются размеры < 15 мм.
Минимальная доза. Dmin – минимальная доза в определенном объеме. Никакого ограничения на величину объема не вводится.
Средняя доза. Средняя доза или средняя доза в мишени рассчитывается усреднением по большому количеству дискретных точек, равномерно распределенных внутри PTV.
Медианная доза в мишени – это центральная величина в последовательности значений доз всех расчетных точек в зоне интереса, упорядоченных по величине.
Модальная доза – это доза, которая наиболее часто встречается в расчетных точках в зоне интереса.
Горячее пятно. Горячее пятно определяется как объем вне PTV, получающий дозу больше 100 % от дозы, назначенной для PTV, или от дозы в контрольной (ссылочной) точке. Объем при этом должен превышать по диаметру 15 мм.
8.4. Движение внутренних органов
Многие годы предполагалось, что положение внутренних органов не изменяется существенно от одного дня к другому и в течение дня. Соответственно, не предпринималось серьезных попыток учесть при планировании и проведении облучения такие перемещения. Эта точка зрения справедлива для областей, где ткань, содержащая опухоль, имеет малые возможности для смещения. Примером может служить мозг. Однако с появлением высокоточных методов и аппаратуры, таких как конформная лучевая терапия и др., это допущение уже оказывается некорректным. Например, при конформной терапии опухолей простаты обеспечивается близкое согласование формы PTV и объема опухоли плюс как можно
231
меньший добавочный объем нормальной ткани. Поэтому пространство допустимых ошибок сильно уменьшается, небольшое смещение простаты может привести к существенному недодозированию опухоли или переоблучению OAR. Простата умеренно фиксирована внутри структуры костей таза серией связок. Впереди нее находится мочевой пузырь, мускульный мешок, подвергающийся периодическому раздуванию и сокращению в соответствии с объемом содержащейся мочи. Позади простаты находится прямая кишка, которая тоже испытывает периодические раздувание и сокращение, связанные с объемом газов и кала. В поперечном направлении находятся относительно неподвижные и негибкие кости стенок таза и бедер. Отсюда ясно, что если не принять меры к согласованному заполнению мочевого пузыря и прямой кишки во время диагностики и последующего процесса облучения, то дневные вариации могут привести не только к изменению положения PTV простаты, но и внедрению стенок мочевого пузыря и прямой кишки в область опухоли. Это явление неоднократно подтверждалось экспериментально.
Хотя общей практикой является добавление однородного слоя вокруг GTV, приводящее к формированию PTV, некоторые авторы (например, авторы работы [12]) высказывают мнение, что толщина этого добавочного слоя нормальной ткани должна быть неоднородной. Так в случае простаты поперечный размер добавляемого объема в работе [12] рекомендуется изменять в пределах от одного до двух сантиметров. Возможно это наилучший компромисс между покрытием CTV и щажением OAR. Подобные данные имеются и для других внутренних органов. Например, почки могут перемещаться вверх/вниз в пределах 4 см.
Необходимо отметить также, что дыхание приводит к вполне измеряемым вариациям в КТ объемных соотношениях между легкими и печенью, что может выражаться в изменении доза-объем гистограмм для этих органов [13]. Для органов, которые перемещаются при дыхании, конечно, не рекомендуется планировать и проводить облучение без применения каких-либо форм временной селекции или системы мониторирования дыхания. Фирмы выпускают специальные устройства, позволяющие контролировать глубину дыхания. В настоящее время появились новейшие ускорители, имеющие в своем составе быстрые КТ сканеры и соответст-
232
вующий терапевтический пучок, который включается в заранее определенный момент дыхательного цикла.
8.5.Дополнение рекомендаций МКРЕ 50
Сцелью разъяснения некоторых спорных моментов и новых вопросов, связанных с определением облучаемых объемов, МКРЕ
в1999 г. выпустила Публикацию № 62 [11], которую следует рассматривать как дополнение к Публикации № 50. Определения GTV и CTV в новой публикации не изменились, так как эти понятия не зависят от технических усовершенствований. Наиболее существенные изменения включают:
Объем между CTV и PTV разделен на internal margin (IM), чтобы учесть вариации в размерах, форме и позиции CTV относитель-
но анатомических рефренсных (опорных) точек, и set up margin (SM) чтобы учесть неопределенности, связанные с погрешностями укладки, воспроизводимостью позиции пациента и механической стабильностью облучающего аппарата. Слово margin имеет в английском языке много значений, в том числе и в переносном смысле. Для него в русском языке нет однозначного перевода и поня
тия. В данном контексте internal margin можно перевести, как «внутреннее окаймление (или припуск)», и set up margin, как «укладочное окаймление (или припуск)». Объединение IM и CTV получило название "internal target volume (ITV или внутренний объем мишени)". Все эти понятия поясняются на рис. 3.24. Их введение может прояснить каким-то образом определение PTV, учитывающее относительные вектора этих неопределенностей при понимании, что процесс в целом представляет собой компромисс, который опирается на опыт и мнение радиотерапевтической команды.
Кроме привычного определения органов риска (OAR) вводятся понятия сериальных, параллельных и сериально-параллельных ор-
ганов риска (serial, parallel и serial-parallel OAR), понимая под этим структурную организацию органов (подробнее см. главу 14, ч.2).
Вводится концепция планируемых объемов органов риска
(planning organ at risk volumes (PRV’s)), которая учитывает изменения в размере, объеме и позиции OAR’s. Отличие PRV’s от OAR’s
233
примерно такое же, как PTV от CTV. PTV и PRV’s могут частично перекрываться. В этом случае превалируют опыт и мнение радиационного онколога, но, как правило, отпускается доза, необходи-
мая для PTV, а щажение OAR’s. меньше принимается во внимание.Вводится концепция индекса конформности (conformity index)
как отношение TV и PTV там, где TV полностью охватывает PTV.
8.6. Выводы и будущие тенденции
Увеличивающаяся сложность планирования облучения и подведения дозы обгоняют наши возможности точно и согласованно оконтуривать объемы, рекомендуемые МКРЕ. Всесторонняя методология, описывающая включение систематических и случайных неопределенностей в определение объема и в процесс планирования облучения была разработана рабочей группой Британского института радиологии [14]. Она разграничила различные источники общей неопределенности:
систематические ошибки, имеющие либо гауссовское (оконтуривание врача: положение, форма и размер мишени; перенос данных с фантома; укладка пациента), либо линейное (дыхание пациента, алгоритм пучка при планировании облучения) распределения;
ошибки при подведении дозы, имеющие гауссовское распределение (ежедневная укладка: позиция, форма и размер ми-
шени).
Новую методологию группа [14] проиллюстрировала на нескольких клинических случаях. Этот подход может показаться слишком обременительным, однако несостоятельность при рассмотрении неопределенностей в каждодневной практике будет отрицательно влиять на результаты облучения и, в конечном счете, приведет к нежелательному сдвигу баланса между контролем над опухолью и заболеваемостью нормальных тканей.
234
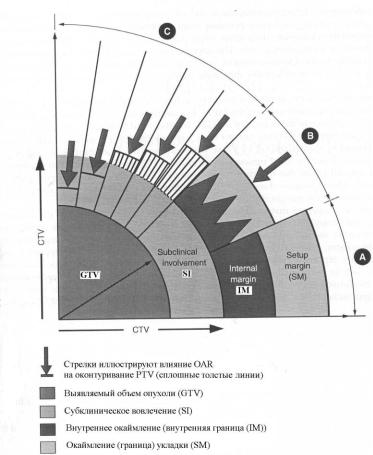
Рис. 3.24. Схематическое представление различных возможных комбинаций неопределенностей, влияющих на разграничение PTV от GTV: A– линейные добавления (припуск) к внешним границам объемов; B – вероятностные добавления IM и SM; С – определение глобального безопасного добавления (припуска), основанное на эмпирическом компромиссе между адекватным покрытием GTV и неприемлемым облучением OAR’s [11]
Будущие улучшения в медицинской визуализации, такие как функциональная визуализация (РEТ или однофотонная эмиссионная компьютерная томография (SPECT)) и их внедрение в процесс планирования внесут заметный вклад в очерчивание GTV для плохо выявляемых опухолей. Необходимо также проводить больше
235
клинико-паталогических исследований для установления связи между типом опухоли, ее размером и стадии и степенью распространения ее микроскопических метастазов вокруг GTV. Эти данные можно использовать для определения оптимальных границ, которые позволительно очертить вокруг опухоли для формирования CTV. Особенно это актуально для опухолей, которые уменьшаются в размерах в результате воздействия химиотерапии или гормонотерапии перед облучением. Большее количество исследований по отношению к движению внутренних органов позволят также лучше оценить границы, необходимые между CTV и ITV.
9. Гистограммы «доза-объем»
При трехмерном планировании план облучения представляет собой трехмерный массив значений доз в точках (точнее в объемных ячейках – вокселях), распределенных в РTV пациента. Таких точек бывает до нескольких сот тысяч. Анализ подобных данных не тривиален. В последнее время для этого стали широко использоваться гистограммы типа доза-объем (ГДО или DVH). Они позволяют суммировать информацию, содержащуюся в трехмерных дозовых распределениях, и являются мощным средством для количественной оценки плана облучения.
В простейшей форме ГДО представляет частотное распределение дозовых значений внутри определенного объема. Вместо частоты обычно применяется величина «процент объема от полного объема», которая откладывается по оси ординат, а по оси абсцисс откладывается значение дозы. На практике используются два вида ГДО:
•прямая (или дифференциальная) ГДО (рис. 3.25);
•кумулятивная (или интегральная) ГДО (рис. 3.26) Недостатком ГДО является потеря пространственной информа-
ции о дозовом распределении.
236
Доза,Гр |
Доза, Гр |
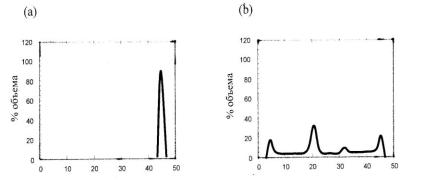
Рис. 3.25. Дифференциальная (прямая) гистограмма доза-объем для четырех полей при облучении простаты: а) – объем мишени; b) – объем прямой кишки. В идеале должен быть узкий пик для мишени и 0,0 Гр для критического органа
9.1. Прямая ГДО
При создании прямой ГДО суммируется число вокселей со средней дозой внутри заданного интервала и рисуется процент от полного объема органа как функция дозы (см. рис. 3.25.). Идеальная прямая ГДО должна иметь одну колонку, указывающую, что 100 % объема получает предписываемую дозу (см. рис. 3.25,а). Для критической структуры ГДО может иметь несколько пиков, указывающих, что отдельные части органа получают разные дозы (см.
рис. 3.25,b).
9.2. Кумулятивная (интегральная) ГДО
Врачей-онкологов при анализе плана облучения традиционно интересует вопрос: «Какая часть мишени будет покрыта 95 % изодозовой кривой?» Прямая ГДО не может дать ответа на этот вопрос. Но он легко получается из кумулятивной ГДО. Поэтому кумулятивные ГДО используются чаще, чем прямые.
237
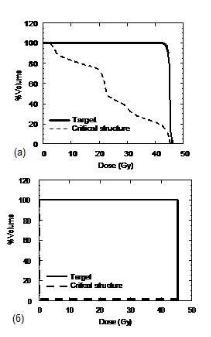
Рис. 3.26. Кумулятивные (интегральные) гистограммы при четырехпольном облучении простаты: а) – реальная гистограмма; б) – идеальная гистограмма
При создании кумулятивной ГДО компьютер рассчитывает величину объема мишени (или OAR), которая получает дозу меньше или равную заданному значению, и рисует график зависимость величины объема (или процент от полного объема) от значения дозы
(рис. 3.26).
Идеальная кумулятивная ГДО для мишени имеет форму функции Хэвисайда (ступенька), а для OAR идеальным вариантом является отрезок у = 0 при х [0,100 %] (рис .3.26,б). На практике
получаются, конечно, другие ГДО, но к идеалу надо при планировании стремиться.
238
Контрольные вопросы к главе 3
1.Какие физические свойства являются наиболее важными для фантомных материалов?
2.Какие материалы наиболее близки к мягкой биологической ткани по отношению к переносу гамма-излучения?
3.Какой детектор обычно применяется для измерения процентной дозы?
4.От каких параметров и как зависит глубинное распределение
Р%?
5.В чем причина образования в глубинных распределениях области накопления (build up)?
6.Каким образом можно перейти от глубинного распределения Р%, измеренного при одном значении РИП (SSD), к глубинному рапределению Р% для другого значения РИП (SSD)?
7.Чем отличается Р% от ОТВ (TAR)?
8.Что такое фактор обратного рассеяния и как он связан с TAR?
9.Как можно рассчитывать TAR, зная распределение Р% ?
10.Какая связь между РИО (SAD) и TAR?
11.В чем заключается принцип расчета дозы от нерегулярных (фигурных) полей по методу Кларксона?
12.В чем причина трудностей применения понятия TAR для расчета дозы от высокоэнергетических пучков?
13.Что такое фактор рассеяния в коллиматоре и как он измеряется?
14.Что такое фактор рассеяния в фантоме и как он измеряется?
15.В чем принципиальное отличие величин TAR от ОТМ (TMR )
иОТФ (TPR)?
16.Как можно рассчитать значение TMR, зная распределение Р% и фактор рассеяния в фантоме?
17.Как рассчитывается число мониторных единиц при облучении по методу постоянного SSD?
18.В чем отличие расчета числа мониторных единиц при облучении по методу постоянного РИП (SSD) от облучения по изоцентрическому методу?
19.Какие особенности расчета дозовых распределений от нерегулярных полей на основе использования TMR и ОРМ (SMR)?
239
20.В чем заключается простой метод для расчета дозы в точках, расположенных вне прямоугольных полей?
21.Опишите простой способ расчета дозы в точках, находящихся под защитным блоком.
22.Какая связь существует между величинами TMR и SMR?
23.Какие области выделяют в дозовом профиле, и с чем они сязаны?
24.Как описывается зависимость дозы от радиуса поля в феноменологической модели для круглых пучков ?
25.Как описывается зависимость дозы от глубины в области накопления в феноменологической модели для круглых пучков ?
Список литературы
1.Khan F. M. The Physics of Radiation Therapy. Second edition / a Waverly company, 1994.
2.Aron B. S., Scapicchio M. Design of universal wedge filter system for a cobalt 60 unit // Am. J. Roentgenol. V. 96. 1966. P.70.
3.Mayneord W. V. The measurement of radiation for medical purposes // Proc. Phys. Soc. V. 54. 1942. P.405.
4.Podgorsak E. B., Rawlinson J.A., Johns H. E. X-ray depth doses for linear accelerators in the energy range from 10 to 32 MeV // Am. J. Roentgenol. V.123. 1975. P.182.
5.Fleming J.S., Orchard P.G. Isocentric radiotherapy treatment planning where the treatment axis is not horizontal // Br. J. Radiol. V.
47.1974. P. 34 – 36.
6.Casebow M.P. The angulation of radiotherapy machines in the treatment of inclined lesions // Br. J. Radiol. V. 49, 1976. P. 278 – 280.
7.Siddon R.L. Solution to treatment planning problems using coordinate transforms // Med. Phys. V. 8. 1981. P. 766 – 774.
8.Handbook of radiotherapy physics. Theory and practice / Edited by F. Mayles, A. Nahum, J.-K. Rosenwald. 2007. Taylor & Francis. New York, London.
9.Atlas of radiation dose distributions. Vol. II of Multiple – field isodose charts / Eds.: M. Martin, S. M. Cohen. International: Atomic Energy. 1966. Vienna,.
240
