
- •Механика.
- •1. Обобщенные координаты. Функция Лагранжа. Принцип наименьшего действия.
- •2. Законы сохранения импульса, момента импульса и энергии. Их связь с однородностью и изотропностью пространства и однородностью времени.
- •3. Движение в центральном поле. Интегралы движения. Уравнение траектории.
- •4. Рассеяние частиц неподвижным силовым центром. Дифференциальное сечение рассеяния. Формула Резерфорда.
- •5. Малые колебания системы материальных точек. Свободные колебания. Затухающие колебания.
- •6. Вынужденные колебания. Явление резонанса.
- •7. Кинематика и динамика твердого тела. Тензор инерции. Момент инерции. Уравнения Эйлера.
- •9. Преобразования Лоренца и их геометрическая интерпретация. Пространство Минковского.
- •Термодинамика. Молекулярная физика. Статистическая физика.
- •10. Тепловая машина Карно. Коэффициент полезного действия.
- •11. Термодинамическое и статистическое определение энтропии. Неравенство Клаузиуса. Второе начало термодинамики.
- •12. Равновесие фаз. Уравнение Клапейрона–Клаузиуса.
- •13. Явление переноса: диффузия и теплопроводность.
- •14. Распределение молекул по скоростям.
- •15. Канонический ансамбль. Статистическое определение свободной энергии.
- •16. Свободная энергия идеального газа. Уравнение состояния и химический потенциал идеального газа.
- •17. Флуктуации термодинамических величин.
- •18. Распределения Ферми–Дирака и Бозе–Эйнштейна.
- •19. Уравнение Ланжевена. Формула Эйнштейна для среднего квадрата смещения броуновской частицы.
- •20. Уравнение Фоккера–Планка для распределения броуновских частиц по скоростям.
- •Электричество. Электродинамика.
- •21. Теорема Гаусса и ее применение к вычислению электрических полей простейших распределений плотности заряда.
- •22. Теорема Стокса и ее применение к вычислению магнитных полей простейших распределений плотности тока.
- •23. Проводники и диэлектрики в электростатическом поле.
- •25. Уравнение непрерывности (закон сохранения заряда) в дифференциальной и интегральной формах.
- •26. Выражения для напряженности электрического и индукции магнитного полей через скалярный и векторный потенциалы. Калибровочная инвариантность.
- •27. Ковариантная формулировка уравнений Максвелла и динамические уравнения для потенциалов.
- •28. Объемная плотность и поток энергии электромагнитного поля.
- •29. Условия на границе раздела двух сред.
- •Оптика.
- •30. Волновое уравнение для электромагнитного поля в вакууме. Плоские монохроматические волны и их свойства. Поляризация электромагнитных волн.
- •32. Распространение света в веществе: дисперсия, фазовая и групповая скорости, комплексный показатель преломления.
- •33. Дифракция электромагнитных волн (приближения Гюйгенса–Френеля и Фраунгофера).
- •34. Распространение света в анизотропных средах.
- •Атомная физика. Квантовая механика.
- •35. Дифракция электронов, атомов, молекул и нейтронов.
- •36. Принципы усиления и генерации оптического излучения. Среды с инверсной заселенностью.
- •37. Эффект Зеемана и эффект Штарка.
- •38. Физические величины и операторы.
- •39. Состояние квантовой системы, чистое и смешанное. Волновая функция и статистический оператор.
- •40. Соотношение неопределенностей, мысленные эксперименты и вывод по Гейзенбергу.
- •41. Развитие системы во времени. Уравнение Шредингера и квантовое уравнение Лиувилля.
- •42. Стационарные состояния свободной частицы и частицы в потенциальной яме. Туннельный эффект, надбарьерное отражение.
- •43. Оператор момента количества движения. Орбитальный, спиновый и полный моменты. Магнитный момент электрона. Мультиплетность спектров.
- •44. Частица в центральном поле. Особенности энергетического спектра частицы в кулоновском поле. Спектры атома водорода и щелочных металлов.
- •45. Оптические спектры атомов и молекул.
- •46. Квазиклассические условия квантования.
- •47. Тождественные квантовые частицы. Принцип Паули, его точная и приближенная формулировки.
- •Ядерная физика.
- •48. Энергия связи. Синтез и деление ядер.
- •49. Виды ядерных превращений.
- •50. Модели атомных ядер.
- •51. Основы систематики элементарных частиц и законы сохранения в микромире.
- •52. Взаимодействия элементарных частиц. Фундаментальные взаимодействия.
- •Физика твердого тела.
- •53. Типы сил связи в кристаллах: ионные, ковалентные, ван-дер-Ваальсовы, металлические. Кристаллические структуры.
- •54. Теорема Блоха и ее основные следствия. Обратная решетка. Зоны Бриллюэна.
- •55. Зонная модель твердого тела. Формирование энергетических зон и их заполнение электронами. Роль граничных условий. Энергия Ферми. Приближение сильно и слабо связанных электронов.
- •56. Электронные свойства полупроводников. Собственная и примесная проводимость. Акцепторные и донорные полупроводники.
- •57. Электронный газ в металлах в приближении свободных электронов. Энергия Ферми и поверхность Ферми.
- •58. Адиабатическое и одноэлектронное приближение.
- •59. Тепловые колебания кристаллических решеток Температура Дебая.
- •60. Квазичастицы в твердом теле (электроны, дырки, фононы, экситоны, поляроны и др.). Дисперсионные зависимости, эффективная масса электронов и дырок.
- •Литература.

Физика твердого тела.
53. Типы сил связи в кристаллах: ионные, ковалентные, ван-дер-Ваальсовы, металлические. Кристаллические структуры.
Природа сил, образующих химическую связь.
Химическая связь имеет электростатическую природу:
электронный обмен между атомами нарушение электронейтральности атомов возникновение электростатических сил между атомами
Правило электронного обмена: электронный обмен между атомами происходит таким образом, чтобы у каждого атома образовалась оболочка, характерная для инертного газа.
Следствия.
1.В случае инертных газов электронный обмен не происходит, т.к. он не способен понизить энергию связи.
2.Замкнутая электронная оболочка, образовавшаяся вследствие электронного обмена близка к сферически симметричной, что позволяет рассматривать атомы как точечные заряды.
3.В электронном обмене участвуют только валентные электроны. Потенциал взаимодействия между атомами описывается функцией вида:
u (R)= RAn − RBm
Обычно выбирается n =10 ÷12 , что моделирует сильное отталкивание на малых расстояниях. Величина m определятся, сходя из типа химической связи.
Типы химической связи.
Ионная связь. (m =1)
Характерный представитель: NaCl. Можно полагать, что валентный электрон покидает Na и переходит к Cl.
Металлическая связь.
Характерные представители: щелочные металлы.
Особенности: для осуществления связи требуется достаточное количество электронов; связь обеспечивается коллективным движением электронов.
Ковалентная связь. (m = 2 ÷4)
Характерные представители: С, Si.
Особенности: образуется между атомами, оболочки которых далеки от заполнения; образуется за счёт парного обобществления электронов.
Свойства.
1.Насыщение. Число атомов, участвующих в связи, определяется числом валентных электронов.
2.Направленность.
3.По электрическим свойствам все ковалентные кристаллы являются полупроводниками.
Ковалентная связь – наиболее общий вид связи, т.е. металлическая и ионная связь являются её предельными случаями.
Водородная связь.
Характерный представитель: H2O
GosPhys8 v7.02 Copyright © 2006 Davyd Tsurikov |
e-mail: DavydTsurikov@mail.ru 40 |

Не связана с электронным обменом.
Молекулярная (Ван-дер-ваальсовая) связь. (m = 6)
Характерные представители: инертные газы. |
|
|
|
Не связана с электронным обменом. Механизм образования: |
|
|
|
наличие флуктуации электронной оболочки |
образование дипольного момента у |
||
атома, наводящего дипольный момент у соседнего |
атома |
|
электростатическое |
притяжение. |
|
|
|
Классификация твёрдых тел по типу связи.
Рассматриваем идеальные кристаллы при T = 0. В этом случае все твёрдые тела можно разделить на две группы: металлы и диэлектрики.
Замечание. Нарушения периодичности кристаллической решётки (наличие дефектов, T ≠ 0 ) диэлектрика с небольшой шириной запрещённой зоны способствуют появлению электронов в зоне проводимости. В этом случае кристалл относят к полупроводникам.
Классификация диэлектриков.([4] с.7-8)
1.Ковалентные кристаллы. Пространственное распределение электронов слабо отличается от случая металлов, однако в k-пространстве отсутствуют частично заполненные зоны. В областях между ионами распределение электронов локализуется вдоль ряда предпочтительных направлений («связи»). Примеры: C, Si.
2.Молекулярные кристаллы. Атомы (молекулы) обладают целиком заполненными электронными оболочками. При формировании твёрдого тела электронная конфигурация претерпевает незначительные изменения. В случае инертных газов электроны локализованы вблизи ионов. Примеры: твёрдые инертные газы, твёрдые H2 и N2 .
3.Ионные кристаллы. Электронный заряд хорошо локализован вблизи ионов. Свойства кристаллов определяют электростатические силы, действующие между ионами. Примеры: кристаллы, образованные металлическими и неметаллическими элементами.
54. Теорема Блоха и ее основные следствия. Обратная решетка. Зоны Бриллюэна.
|
|
|
|
eff |
|
|
eff |
|
eff |
|
Исходная задача: |
− |
2 |
+u |
(x) ψ (x)= Eψ (x) |
u |
(x)= u |
(x +an ) |
|||
2m |
|
|
|
ueff – эффективный потенциал, учитывающий взаимодействие электрона с кристаллической решёткой и остальными электронами.
an – вектор решётки
Теорема Блоха: ψ (x +an )=ψ (x)eiank
k = k1b1 + k2b2 + k3b3 – квазиволновой вектор
bi – базисные векторы обратной кристаллической решётки. aibj =δij
Следствия теоремы Блоха.
1. |
Идеальная решётка является сверхпроводящей |
|
сопротивление вызвано |
|
нарушениями периодичности кристаллической решётки. |
|
|
2. |
Введение понятия квазиволнового вектора. |
|
|
Зона Бриллюэна – многогранник в k -пространстве, в котором сосредоточены все значения k , однозначно определяющие электронное состояние.
GosPhys8 v7.02 Copyright © 2006 Davyd Tsurikov |
e-mail: DavydTsurikov@mail.ru 41 |
55. Зонная модель твердого тела. Формирование энергетических зон и их заполнение электронами. Роль граничных условий. Энергия Ферми. Приближение сильно и слабо связанных электронов.
Качественное объяснение формирования энергетических зон. При сближении атомов друг с другом их энергетические уровни начинают расщепляться. Количество уровней, на которые произойдёт расщепление, зависит от геометрических размеров образовавшегося кристалла и является следствием граничных условий. Для массивного кристалла уровни в зоне расположены настолько близко друг к другу, что говорят о т.н. квазинепрерывном спектре. Ширина энергетических зон является индивидуальной характеристикой кристалла. Появление энергетических зон в кристалле говорит о том, что в кристалле образуется общая электронная система.
Заполнение энергетических зон электронами описывается в рамках статистики Ферми– Дирака.
Энергия Ферми (уровень Ферми) – максимальная энергия электронов при T = 0 . У металла уровень Ферми лежит в зоне проводимости, у диэлектрика – в запрещённой зоне.
Приближённое решение уравнения Шрёдингера в случае твёрдого тела.
1.Приближение свободных электронов. Рассматривается УШ для свободного электрона, используются циклические граничные условия, учитывается симметрия кристаллической решётки.
2.Приближение сильно связанных электронов. Нулевое приближение: электрон в атоме.
3.Приближение слабо связанных электронов. Нулевое приближение: свободный электрон.
56. Электронные свойства полупроводников. Собственная и примесная проводимость. Акцепторные и донорные полупроводники.
Электронные свойства полупроводников.
1.Электропроводность является промежуточной между металлом и диэлектриком.
2.Изменчивость электронных свойств.
3.Наличие двух типов проводимости: электронная и дырочная.
Соглашения.
Направление энергетической оси (единое для электронов и дырок): EV < EC
|
|
EV – уровень V-зоны |
EC – уровень С-зоны |
|
||||
Eg := |
|
EC − EV |
|
> 0 – ширина запрещённой зоны |
|
|
|
|
|
|
|
|
|
|
|||
Ef – уровень Ферми (обычно располагается в |
запрещённой |
зоне |
|
Ef < 0 ), |
||||
физический смысл: при E = Ef n =1 2 , т.е. |
заселённость |
уровня |
с |
энергией, |
||||
соответствующей уровню Ферми, равна ½ (среднее число фермионов с энергией Ef равно
½). Один для электронов и дырок.
Замечание. В данном случае термин «уровень Ферми» подменяет термин «уровень химического потенциала», что, вообще говоря, не является корректным, но обусловлено сложившейся терминологией в физике полупроводников.
ε := E 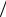 kT – безразмерная энергетическая характеристика E в единицах kT. p – квазиимпульс (локально: электрона или дырки)
kT – безразмерная энергетическая характеристика E в единицах kT. p – квазиимпульс (локально: электрона или дырки)
GosPhys8 v7.02 Copyright © 2006 Davyd Tsurikov e-mail: DavydTsurikov@mail.ru 42

Концентрация электронов.
В случае изотропного параболического закона дисперсии:
|
p2 |
|
E = E + |
|
– энергия электрона в С-зоне m – эффективная масса электрона |
|
||
C |
|
e |
|
2me |
|
Выражение для концентрации электронов в зоне проводимости получается по аналогии со случаем металлов:
|
|
|
|
|
|
|
|
|
||||||
ne (μe )= NC F1/ 2 (μe ) |
|
|
концентрация электронов в C-зоне |
|||||||||||
NC := 2 |
m kT 3/ 2 |
эффективная плотность состояний в C-зоне |
||||||||||||
|
|
|
e |
|
|
|
|
|
|
|
|
|||
2π |
2 |
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
безразмерный уровень химического потенциала для |
||||
μe := ε f |
−εC |
|
|
|
|
|
||||||||
|
|
|
|
|
электронов |
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
F1/ 2 (μ):= |
|
2 |
|
|
+∞ |
|
ε |
|
|
|||||
|
|
|
|
∫0 |
dε |
|
|
интеграл Ферми–Дирака с индексом ½ |
||||||
|
π |
eε −μ +1 |
||||||||||||
Концентрация дырок. |
|
|
||||||||||||
E = E − |
|
|
p2 |
– энергия дырки в V-зоне |
m – эффективная масса дырки |
|||||||||
|
|
|
|
|
|
|||||||||
V |
|
|
2mh |
|
|
|
|
|
|
h |
||||
|
|
|
|
|
|
|
|
|
|
|||||
Замечание. В выражении для энергии дырки стоит знак «–», т.к. формально масса квазичастицы отрицательна (ср. позитрон), но везде далее используется положительное
значение массы. |
|
|
|
|
|
|
|
|||||||
n =1− |
|
|
|
1 |
|
|
= |
|
1 |
|
|
|
||
e |
(E−E f ) kT |
+1 |
e |
(E f −E) |
kT |
+1 |
||||||||
|
|
|
|
|
|
|
|
|
||||||
Аналогично случаю электронов: |
||||||||||||||
|
|
|
|
|
||||||||||
|
nh (μh )= NV F1/ 2 (μh ) |
|
|
концентрация дырок в V-зоне |
||||||||||
|
NV := 2 |
m kT 3/ 2 |
|
|
|
|
|
эффективная плотность состояний в V-зоне |
||||||
|
|
h |
|
|
|
|
|
|
|
|||||
|
2 |
|
|
|
|
|
|
|||||||
|
|
|
|
2π |
|
|
|
|
|
|
|
|
|
|
μh := εV |
|
−ε f |
|
|
|
|
|
|
|
безразмерный уровень химического потенциала для дырок |
||||
В случае полупроводника с непараболическим законом дисперсии полученные результаты остаются в силе, при этом величины me , mh следует интерпретировать как
эффективные массы плотности состояний электронных и дырочных соответственно.
Уровень химического потенциала определяется только свойствами полупроводника: концентрацией носителей, температурой. Уровень электрохимического потенциала определяется как: μe := ε f −εC −eυ , μh := εV −ε f +eυ .
Невырожденный полупроводник.
Величина уровня химического потенциала для электронов и дырок определяет
критерии вырождения. |
|
|
|
|||
Невырожденный электронный (дырочный) |
газ – электронный (дырочный) |
газ, |
||||
который достаточно хорошо описывается статистикой Максвелла–Больцмана: |
|
|||||
|
ne (μe )= NC exp(μe ) |
|
nh (μh )= NV exp(μh ) |
|
||
Утв. F1/ 2 (μ) |
|
exp(μ) |
|
|
|
|
|
|
μ→−∞ |
|
|
|
|
|
|
|
условие отсутствия вырождения (по соглашению) |
|
||
|
2kT + EV < Ef |
< EC −2kT |
|
|||
Для невырожденного п/п выполняется: |
|
|
||||
GosPhys8 v7.02 Copyright © 2006 Davyd Tsurikov |
e-mail: DavydTsurikov@mail.ru |
43 |
||||
