
- •Росжелдор
- •Введение: основные понятия и определения
- •Основы номенклатуры неорганических соединений можно изложить следующим образом:
- •1 Классы неорганических соединений
- •Растворимость солей, кислот и оснований в воде
- •2 Химическая термодинамика
- •3 Скорость химических реакций
- •3.1 Количественное определение скорости химической реакции
- •3.2 Влияние катализатора
- •4 Химическое равновесие
- •4.1 Понятие о химическом равновесии
- •4.2 Динамический характер и устойчивость химического равновесия
- •4.3 Константа химического равновесия
- •4.4 Положение равновесия и его зависимость от внешних факторов
- •4.4.1 Зависимость равновесия от концентрации
- •4.4.2 Зависимость равновесия от температуры
- •4.4.3 Влияние давления на равновесие
- •4.4.4 Влияние катализатора на равновесие
- •В выражение константы равновесия входят равновесные концентрации веществ:
- •5 Строение электронных оболочек атомов. Периодический закон д.И. Менделеева
- •6 Химическая связь и строение молекул
- •7 Растворы
- •7.1 Способы выражения концентрации растворов
- •7.2 Физико-химические свойства разбавленных растворов неэлектролитов. Давление пара растворов. Закон Рауля
- •7.2.1 Понижение температуры замерзания и повышение температуры кипения растворов (следствия из закона Рауля)
- •7.3 Растворы электролитов
- •7.4 Ионное произведение воды. Водородный показатель рН
- •8 Окислительно-восстановительные реакции
- •9 Гальванические элементы
- •9.1 Понятие об электродном потенциале
- •9.2 Гальванический элемент
- •10 Коррозия металлов
- •10.1 Защита от коррозии
- •11 Электролиз
- •11.1 Катодные процессы
- •11.2 Анодные процессы
- •12 Полимеры
- •12.1 Реакция полимеризации
- •12.2 Реакция поликонденсации
- •12.3 Полимерные материалы
- •13 Дисперсные системы
- •14 Химический анализ
- •Библиографический список
- •Содержание
- •Мигаль Юрий Фёдорович
4.4.4 Влияние катализатора на равновесие
Введение катализатора в равновесную систему не изменяет положение химического равновесия, так как катализатор в одинаковой мере увеличивает скорость прямой и обратной реакций.Однако роль катализаторов при проведении обратимых реакций очень высока. При низких температурах в силу малых скоростей прямой и обратной реакций, равновесие часто устанавливается очень медленно. Поэтому приходится ждать долгое время, чтобы добиться получения необходимых количеств продуктов реакции. Повышение температуры для этой цели не всегда приемлемо. Если реакция экзотермична, то равновесие сместится в сторону исходных веществ. Применение же катализатора позволяет ускорить наступление равновесия, не повышая температуры, и получить необходимые продукты реакции в нужном количестве.
Пример 1. Константа равновесия гомогенной системы A(Г) + B(Г) 2C(Г) равна 0,5. Вычислите равновесные концентрации реагирующих веществ, если начальные концентрации равны C0А = 3 моль/л, С0В = 5 моль/л.
Решение
Пусть к моменту установления равновесия начальные концентрации C0АиС0В уменьшится нахмолей. Так как из одного моляАиВобразуется 2 моля веществаС, то∆CС= 2xмоль/л. В начальный момент веществаСне было. Составим таблицу изменения концентраций:
-
Концентрация
Вещества
А
В
С
С0
3
5
0
С
х
х
2x
С
3 – x
5 – x
2x
В выражение константы равновесия входят равновесные концентрации веществ:
![]() .
.
Подставив значения, получим:
![]() ;
;
![]() ;
;![]() =
1 моль/л.
=
1 моль/л.
Таким образом, искомые равновесные концентрации равны:
СА = 3 – 1 = 2 моль/л;СВ= 5 – 1 = 4 моль/л;СС= 2∙1 = 2 моль/л.
Пример
2. В процессе синтеза аммиакаN2+ 3H22NH3равновесие
установилось при следующих концентрациях
веществ (моль/л):![]() = 2,5;
= 2,5;![]() = 1,8;
= 1,8;![]() =3,6.
Рассчитайте константу равновесия
реакции и исходные концентрации азота
и водорода. Начальная концентрация
аммиака равна нулю.
=3,6.
Рассчитайте константу равновесия
реакции и исходные концентрации азота
и водорода. Начальная концентрация
аммиака равна нулю.
Решение
Составляем таблицу изменения концентраций, в которую вносим из условия задачи равновесные концентрации. Определяем константу равновесия этой реакции
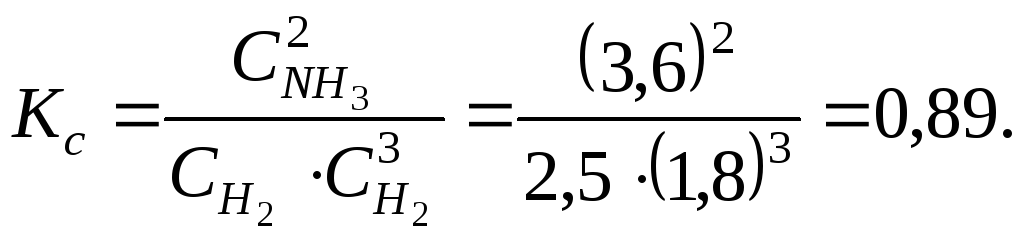
Поскольку в начальный момент времени аммиака не было, то в ходе реакции изменение его концентрации составило 3,6 моля. Изменение концентраций ΔС участников равновесия пропорционально коэффициентам в уравнении реакции.
|
Концентрации |
Вещества | ||
|
H2 |
N2 |
NH3 | |
|
C0 |
7,2 |
4,3 |
0 |
|
∆C |
5,4 |
1,8 |
3,6 |
|
C |
1,8 |
2,5 |
3,6 |
Исходные концентрации азота и водорода находим путем сложения равновесных концентраций с их изменениями в ходе реакции.
Пример
3.Химическое равновесие реакцииCO2+H2CO+H2Oв газовой фазе установилось при следующих
концентрациях реагирующих веществ
(моль/л):![]() = 7,
= 7,![]() = 5,
= 5,![]() = 10,
= 10,![]() = 14. Равновесие системы было нарушено
из-за уменьшения концентрации H2Oдо 11 моль/л. Вычислить новые равновесные
концентрации реагирующих веществ (С’)
после смещения равновесия.
= 14. Равновесие системы было нарушено
из-за уменьшения концентрации H2Oдо 11 моль/л. Вычислить новые равновесные
концентрации реагирующих веществ (С’)
после смещения равновесия.
Решение
Согласно принципу Ле-Шателье, при уменьшении концентрации H2Oравновесие сместилось в сторону прямой реакции, т.е. концентрации CO2и H2уменьшились, а концентрации CO и H2Oувеличились на одинаковую величину, так как все вещества реагируют в одинаковом соотношении.
Обозначим изменение концентрации всех веществ через хмоль/л. После смещения равновесия новые равновесные концентрации реагирующих веществC(моль /л) стали такими, как указано в таблице.
Составляем таблицу изменения концентраций.
|
Концентрации |
Вещества | |||
|
CO2 |
H2 |
СO |
H2O | |
|
C |
7 |
5 |
10 |
14 |
|
∆C |
X |
X |
X |
X |
|
C’ |
7 –x |
5 –x |
10 + x |
11 + x |
Константа равновесия данной реакции равна:
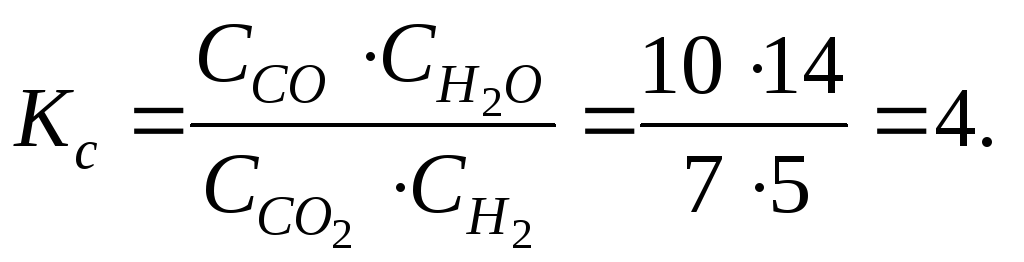
Подставляем новые равновесные концентрации C’в выражение для константы равновесияKс:.
![]() .
.
Найдем корни этого уравнения:
![]()
Корень х1= 22,6 мы отбрасываем, поскольку уменьшение концентрации CO2и H2не может быть большим, чем исходные концентрации этих веществ. Поэтому реальным будет кореньx2= 0,44 моль/л. Тогда новыми равновесными концентрациями будут:
![]() =
7 – 0,44 = 6,56
моль/л;
=
7 – 0,44 = 6,56
моль/л; ![]() = 5 – 0,44 = 4,56
моль/л;
= 5 – 0,44 = 4,56
моль/л;
![]() =
10 + 0,44 = 10,44 моль/л;
=
10 + 0,44 = 10,44 моль/л; ![]() = 11 + 0,44 = 11,44 моль/л.
= 11 + 0,44 = 11,44 моль/л.
Пример 4.Вычислите константу равновесия приТ= 298 К для реакции 2NO2(Г)N2O4(Г), пользуясь значениями ∆G0298.
Решение
Вычисляем
![]()
Подставляя в уравнение
![]() числовые значения, получаем:
числовые значения, получаем:
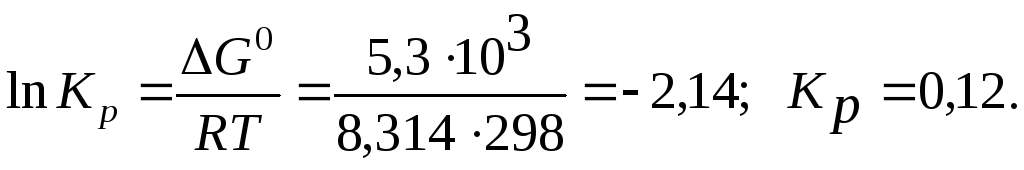
Задачи
81Константа равновесия гомогенной системыA+B2Cравна 50. Вычислите равновесные концентрации реагирующих веществ, если исходные концентрации веществАиВсоответственно равны 0,5 и 0,7 моль/л, а веществаСв начале реакции не было.
Ответ: СA= 0,06;CB= 0,26;Cc= 0,88. Все в моль/л.
82Реакция протекает по уравнению:CO(Г)+Cl2(г)COCl2(Г).Начальные
концентрации CO и Cl2равны: (моль/л):СCO= 0,28;![]() =
0,09. Начальная концентрация СОСl2равна нулю. Равновесная концентрация
CO равна 0,2 моль/л. Вычислите константу
равновесия.
=
0,09. Начальная концентрация СОСl2равна нулю. Равновесная концентрация
CO равна 0,2 моль/л. Вычислите константу
равновесия.
Ответ: 40.
83Реакция протекает по уравнениюA(Г)+B(Г) C(Г)+D(Г). Исходные
концентрации веществ![]() = 0,8 моль/л,
= 0,8 моль/л,![]() = 0,8 моль/л, а равновесная концентрация
веществаС= 0,6 моль/л. Вычислите
константу равновесия.
= 0,8 моль/л, а равновесная концентрация
веществаС= 0,6 моль/л. Вычислите
константу равновесия.
Ответ: 9.
84В системе 2NO2 2NO+O2равновесная концентрацияNO2равна 0,06 моль/л,NO–равна 0,24 моль/л,O2–равна 0,12 моль/л. Вычислите константу равновесия и исходную концентрацию NO2.
Ответ: 1,92; 0,3 моль/л.
85 Равновесная концентрация в системе N2O4 2NO2 для N2O4 равна 0,02 моль/л, а для NO2 – 0,03 моль/л. Вычислите равновесные концентрации после смещения равновесия в результате увеличения давления в 3 раза.
Ответ: концентрация N2O4 равна0,076 моль/л; концентрацияNO2 равна0,058 моль/л.
86–89Химическое равновесие гомогенной системыA+BC+Dустановилось при концентрациях (моль/л), указанных в таблице. Затем концентрацию одного из веществ увеличили (+) или уменьшили (–) на величину, указанную в скобках. Вычислите новые равновесные концентрации веществ после смещения равновесия.
|
№ задачи |
A |
B |
C |
D |
|
86 |
9 |
8 |
6(–6) |
12 |
|
87 |
0,04 (–0,04) |
0,64 |
0,16 |
0,16 |
|
88 |
2 |
20 |
4 |
8 (+8) |
|
89 |
18 |
16 |
12(–12) |
24 |
Ответы: 86) СA= 6,52;CB= 5,52;CС = 2,48;CD= 14,48. Все в моль/л;
87) СA= 0,027;CB= 0,667;CC= 0,133;CD= 0,133. Все в моль/л;
88) СA = 2,85;CB = 20,85;CC =3,15;CD= 15,15. Все в моль/л;
89) СA= 13,04;CB = 11,04;CC= 4,96;CD= 28,96. Все в моль/л.
90Химическое равновесие реакцииA(Г) B(Г) +C(Г)установилось при следующих концентрациях реагирующих веществ (моль/л):СA = 10,CB= 2,CC= 4. В равновесную систему добавили веществоСв количестве 4 моль/л. Вычислите новые равновесные концентрации реагирующих веществ после смещения равновесия.
Ответ: CA= 10,8;CB=1,2;CC= 7,2. Все в моль/л.
91Все равновесные концентрации веществ, участвующих в реакцииCH3COOH+C2H5OHCH3COOC2H5+H2O, равны 0,02 моль/л. Вычислите новые равновесные концентрации после смещения равновесия вследствие увеличения концентрацииC2H5OHв 4 раза.
Ответ: [CH3COOH] = 0,011 моль/л; [C2H5OH] = 0,079 моль/л;
[CH3COOC2H5] = 0,029 моль/л; [H2O] = 0,029 моль/л.
92Равновесные концентрации веществ в системеCO+Cl2COCl2равны: [CO] =0,02; [Cl2] = 0,01; [COCl2] = 0,02 моль/л. Равновесие нарушено вследствие увеличения концентрацииCl2на 0,003 моль/л. Вычислите новые равновесные концентрации после смещения равновесия.
Ответ: [CO] = 0,0186 моль/л; [Cl2] = 0,0116 моль/л;
[COCl2] = 0,0214 моль/л.
93Равновесные концентрации веществ, участвующих в реакции PCl5PCl3+Cl2, равны (моль/л): [PCl5] = 0,005; [PCl3] = 0,06; [Cl2] = 0,08. Вычислите новые равновесные концентрации после смещения равновесия вследствие увеличения концентрации хлора в 2 раза.
Ответ: [PCl5 ] = 0,009 моль/л; [PCl3] = 0,056 моль/л;
[Cl2] = 0,156 моль/л.
94Константа равновесия гомогенной реакцииA+BC+Dравна 1,5. Начальные концентрации веществАиВравны 5 и 6 моль/л соответственно, а концентрации веществСиDравны нулю. Вычислите равновесные концентрации всех веществ.
Ответ: CА= 2 моль/л;CВ= 3 моль/л;СС=СD= 3 моль/л.
95Реакция синтеза аммиака протекает по
уравнениюN2+ 3H22NH3.
Константа равновесияKP=5,34.10–10. Вычислите парциальное
давление аммиака![]() ,
если равновесные парциальные давления
,
если равновесные парциальные давления![]() = 65,7.103, а
= 65,7.103, а![]() = 65,7.103Па.
= 65,7.103Па.
Ответ: 99,7.103Па.
96Исходные концентрацииNOи Cl в системе 2NO + Cl2 2NOClравны:![]() = 2;
= 2;![]() = 3 (моль/л). Вычислите константу равновесия,
если к моменту наступления равновесия
прореагировало 20 %NO.
= 3 (моль/л). Вычислите константу равновесия,
если к моменту наступления равновесия
прореагировало 20 %NO.
Ответ: 0,022.
97
В химической реакции H2(Г)
+ I2(Г)
2HI(Г)
в момент равновесия установились
следующие концентрации реагирующих
веществ (моль/л):
![]() = 0,25;
= 0,25;![]() = 0,05;
= 0,05;![]() = 0,9.Вычислите начальные концентрации
водорода и иода, если в начале реакции
концентрация йодоводорода была равна
нулю.
= 0,9.Вычислите начальные концентрации
водорода и иода, если в начале реакции
концентрация йодоводорода была равна
нулю.
Ответ:
![]() = 0,7;
= 0,7;
![]() = 0,5. Все в моль/л.
= 0,5. Все в моль/л.
98Реакция протекает по уравнению 2CO2 2CO+O2. Состав равновесной смеси при 2000 ˚С следующий: 85,2 %CO2, 9,9 % CO и 4,9 % O2, а общее давление в системе при этой же температуре равно 101,3.103 Па. Вычислите константу равновесияKP.
Ответ: 66,98.
99В состоянии равновесия системы CO2+H2 CO+H2Oреакционная смесь имела объемный состав: 22 % CO2. 41 % H2, 17 % CO, 20 % H2O. ВычислитеKPданной реакции.
Ответ: 0,38.
100–103Вычислите константы равновесия
гомогенных реакций в газовой фазе,
пользуясь значениями![]() веществ участников реакции (нумерация
веществ идет по реакции слева направо).
веществ участников реакции (нумерация
веществ идет по реакции слева направо).
|
№ задачи |
Уравнение реакции |
|
Ответ | |||||
|
1 |
2 |
3 |
4 |
1 |
3 |
4 | ||
|
100 101 102 103 |
SO2 + Cl2 SO2Cl2 SO2 +1/2O2 SO3 CO + 1/2O2 CO2 CO2 + H2 CO + H2O |
–300 –300 –137 –394 |
–315 –370 –394 –137 |
–229 |
4,3.102 1,9.1012 1,1.1045 1,2.10-5 | |||
104Константа равновесия реакции CO + H2OCO2+H2при 727 ˚Cравна 1,4, а при 927˚Cравна 0,78. Вычислите ∆G0этой реакции при разных температурах и определите, куда смещается равновесие с ростом температуры.
Ответ: –2,8 кДж/моль; +2,5 кДж/моль.
Равновесие смещается в сторону обратной реакции
105–107 Реакция протекает по уравнению 2A2B+C. Найти начальную концентрацию веществаАпри заданной константе равновесия и равновесной концентрации веществаС, моль/л. В начале реакции веществаВиСотсутствовали.
|
№ задачи |
K |
[C], моль/л |
Ответ, моль/л |
|
105 106 107 |
8 1 25 |
2 0,4 0,25 |
6 1,31 0,55 |
108–110Обратимая реакция протекает по уравнению 2A+ 3B6C+D. Вычислите равновесную концентрацию веществаС, [C], и начальные концентрации веществАиВ,CAиCB, по равновесным концентрациям веществ, указанным в таблице. В начале реакции веществаСиDотсутствовали.
|
№ задачи |
[A] |
[B] |
[D] |
|
108 109 110 |
0,2 1,1 1,6 |
0,4 0,8 1,2 |
1,4 0,5 0,8 |
Ответы:
108) [C] = 8,4; CA = 3,0; CB = 4,6. Все в моль/л.
109) [C] = 3,0; CA = 2,1; СB = 2,3. Все в моль/л.
110) [C] = 4,8; CA = 3,2; CB = 3,6. Все в моль/л.
