
- •Росжелдор
- •Введение: основные понятия и определения
- •Основы номенклатуры неорганических соединений можно изложить следующим образом:
- •1 Классы неорганических соединений
- •Растворимость солей, кислот и оснований в воде
- •2 Химическая термодинамика
- •3 Скорость химических реакций
- •3.1 Количественное определение скорости химической реакции
- •3.2 Влияние катализатора
- •4 Химическое равновесие
- •4.1 Понятие о химическом равновесии
- •4.2 Динамический характер и устойчивость химического равновесия
- •4.3 Константа химического равновесия
- •4.4 Положение равновесия и его зависимость от внешних факторов
- •4.4.1 Зависимость равновесия от концентрации
- •4.4.2 Зависимость равновесия от температуры
- •4.4.3 Влияние давления на равновесие
- •4.4.4 Влияние катализатора на равновесие
- •В выражение константы равновесия входят равновесные концентрации веществ:
- •5 Строение электронных оболочек атомов. Периодический закон д.И. Менделеева
- •6 Химическая связь и строение молекул
- •7 Растворы
- •7.1 Способы выражения концентрации растворов
- •7.2 Физико-химические свойства разбавленных растворов неэлектролитов. Давление пара растворов. Закон Рауля
- •7.2.1 Понижение температуры замерзания и повышение температуры кипения растворов (следствия из закона Рауля)
- •7.3 Растворы электролитов
- •7.4 Ионное произведение воды. Водородный показатель рН
- •8 Окислительно-восстановительные реакции
- •9 Гальванические элементы
- •9.1 Понятие об электродном потенциале
- •9.2 Гальванический элемент
- •10 Коррозия металлов
- •10.1 Защита от коррозии
- •11 Электролиз
- •11.1 Катодные процессы
- •11.2 Анодные процессы
- •12 Полимеры
- •12.1 Реакция полимеризации
- •12.2 Реакция поликонденсации
- •12.3 Полимерные материалы
- •13 Дисперсные системы
- •14 Химический анализ
- •Библиографический список
- •Содержание
- •Мигаль Юрий Фёдорович
4.3 Константа химического равновесия
Выразим математически наличие химического равновесия в системе, для чего, по определению равновесия, приравняем правые части выражений (4.2) и (4.3), а затем соберем все постоянные величины в одной части равенства, а переменные – в другой:
|
|
|
|
|
|
|
(4.4) |
Величина Kcназывается константой равновесия химической реакции. Индекс «c» означает, что константа определена по концентрациям. В уравнении (4.4) концентрации отвечают равновесию и поэтому называются равновесными концентрациями. Уравнение (4.4) есть результат применения закона действующих масс к химическому равновесию.Константа химического равновесия Kc реагирующей системы равна произведению равновесных концентраций продуктов, возведенных в степени их стехиометрических коэффициентов, деленному на произведение равновесных концентраций реагентов, возведенных в степени своих стехиометрических коэффициентов.
Аналогичным образом легко получить другое выражение для константы химического равновесия гомогенной реакции в газовой фазе, учитывая, что концентрации реагирующих веществ пропорциональны их парциальным давлениям
|
|
|
(4.5) |
где индекс «p» означает,
что константаKpопределена через парциальные давления
реагирующих веществ![]() ,
,![]() ,
,![]() ,
,![]() в соответствующих степенях стехиометрических
коэффициентов уравнения реакции.
Константа химического равновесия Kpреагирующей системы равна произведению
равновесных парциальных давлений
продуктов, возведенных в степени их
стехиометрических коэффициентов,
деленному на произведение равновесных
парциальных давлений реагентов,
возведенных в степени своих стехиометрических
коэффициентов. Константы химического
равновесияKcиKpзависят от природы реагентов и температуры.
в соответствующих степенях стехиометрических
коэффициентов уравнения реакции.
Константа химического равновесия Kpреагирующей системы равна произведению
равновесных парциальных давлений
продуктов, возведенных в степени их
стехиометрических коэффициентов,
деленному на произведение равновесных
парциальных давлений реагентов,
возведенных в степени своих стехиометрических
коэффициентов. Константы химического
равновесияKcиKpзависят от природы реагентов и температуры.
В выражения для констант равновесия (4.4) и (4.5) гетерогенных реакций концентрации твердых веществ не заносятся, если остальные реагенты – жидкости или газы, так как эти величины неизменны в процессе реакции. Ниже, в качестве примера, приводятся выражения для констант равновесия некоторых гомогенных и гетерогенных реакций. Отметим, что равновесные молярные концентрации часто принято обозначать с помощью квадратных скобок, в которые помещена формула соответствующего вещества.
Н2 + I2 2НI
![]() ,
,
 ;
;
2Cu2O + O2 4 CuO
![]() ,
,![]() ;
;
N2+ 3H22NH3
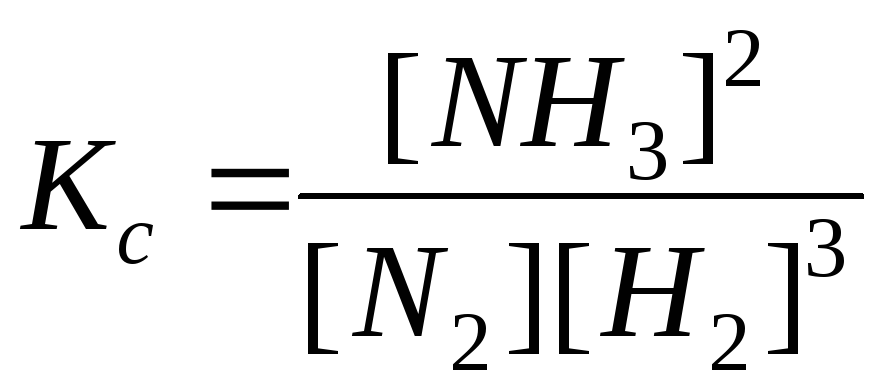 .
.
В термодинамике доказывается тесная связь между величиной изменения стандартного изобарного потенциала ΔG0химической реакции и константой равновесия химической реакцииKp, что отражается формулой (4.6):
|
|
|
(4.6) |
Формула (4.6) выводится из термодинамического критерия химического равновесия в изобарно-изотермических условиях термодинамической системы, согласно которому изменение изобарного потенциала ΔGреагирующей системы в окрестности химического равновесия равно нулю. Следует отметить, что в формуле (4.6) величина константы равновесияKpявляется безразмерной, так как при её выводе используются не конкретные парциальные давления реагентов, а отношение этих парциальных давлений к стандартному давлению, которое обычно принимается равным одной физической атмосфере.

 .
.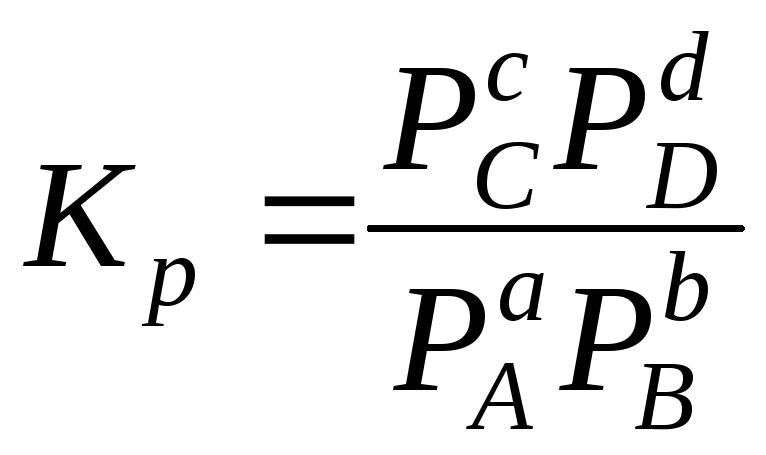 ,
,