
- •Росжелдор
- •Введение: основные понятия и определения
- •Основы номенклатуры неорганических соединений можно изложить следующим образом:
- •1 Классы неорганических соединений
- •Растворимость солей, кислот и оснований в воде
- •2 Химическая термодинамика
- •3 Скорость химических реакций
- •3.1 Количественное определение скорости химической реакции
- •3.2 Влияние катализатора
- •4 Химическое равновесие
- •4.1 Понятие о химическом равновесии
- •4.2 Динамический характер и устойчивость химического равновесия
- •4.3 Константа химического равновесия
- •4.4 Положение равновесия и его зависимость от внешних факторов
- •4.4.1 Зависимость равновесия от концентрации
- •4.4.2 Зависимость равновесия от температуры
- •4.4.3 Влияние давления на равновесие
- •4.4.4 Влияние катализатора на равновесие
- •В выражение константы равновесия входят равновесные концентрации веществ:
- •5 Строение электронных оболочек атомов. Периодический закон д.И. Менделеева
- •6 Химическая связь и строение молекул
- •7 Растворы
- •7.1 Способы выражения концентрации растворов
- •7.2 Физико-химические свойства разбавленных растворов неэлектролитов. Давление пара растворов. Закон Рауля
- •7.2.1 Понижение температуры замерзания и повышение температуры кипения растворов (следствия из закона Рауля)
- •7.3 Растворы электролитов
- •7.4 Ионное произведение воды. Водородный показатель рН
- •8 Окислительно-восстановительные реакции
- •9 Гальванические элементы
- •9.1 Понятие об электродном потенциале
- •9.2 Гальванический элемент
- •10 Коррозия металлов
- •10.1 Защита от коррозии
- •11 Электролиз
- •11.1 Катодные процессы
- •11.2 Анодные процессы
- •12 Полимеры
- •12.1 Реакция полимеризации
- •12.2 Реакция поликонденсации
- •12.3 Полимерные материалы
- •13 Дисперсные системы
- •14 Химический анализ
- •Библиографический список
- •Содержание
- •Мигаль Юрий Фёдорович
10 Коррозия металлов
Коррозия – самопроизвольное разрушение металлов в результате взаимодействия с окислителями окружающей среды.
Это окислительно-восстановительный процесс, в котором металл выступает в качестве восстановителя. Первопричиной коррозии является термодинамическая неустойчивость металла в окружающей среде и возможность его перехода в более устойчивое (окисленное) состояние.
Иногда коррозию называют ржавлением. Ржавление – коррозия железа и его сплавов с образованием продуктов коррозии, состоящих в основном из гидроксидов железа разной степени гидратации, желто-коричневого цвета. Цветные металлы корродируют, но не ржавеют. По характеру разрушения коррозия делится на избирательную, сплошную (равномерную и неравномерную), локальную (пятнистую, питтинговую, или язвенную), коррозионное растрескивание и межкристаллическую коррозию. По виду среды, в которой протекает процесс, коррозия бывает почвенной, атмосферной, электролитической, газовой, под действием блуждающих токов. В зависимости от механизма протекания и внешних условий коррозию подразделяют на химическую и электрохимическую.
Химическая
коррозия
протекает в газовой среде при повышенных
температурах (в отсутствие влаги) или
в жидких неэлектролитах. Сущность
процессов коррозии этого вида сводится
к окислительно-восстановительной
реакции, осуществляемой при непосредственном
переходе электронов металла на
окислитель. В качестве окислителя могут
выступать такие газы, как O![]() ,
SO
,
SO![]() ,
Cl
,
Cl![]() ,
HCl
и др. Коррозии способствует также H2S,
CO
,
HCl
и др. Коррозии способствует также H2S,
CO![]() .
В результате реакции на поверхности
металла образуются пленки оксидов,
сульфидов, хлоридов и т. д.
.
В результате реакции на поверхности
металла образуются пленки оксидов,
сульфидов, хлоридов и т. д.
Развитие коррозии происходит за счет переноса катионов металла, частиц окислителя или электронов через образовавшуюся пленку. Если пленка плотная, сплошная, хорошо сцепленная с металлом, то дальнейшее окисление металла протекает очень медленно. Такие пленки могут быть использованы для защиты металлов от коррозии. Наоборот, рыхлая пленка не способна защитить металл от последующего окислительно-восстановительного взаимодействия с окружающей средой. Защитные свойства образовавшихся продуктов коррозии определяется на основании расчета фактора рыхлости Ф:
|
|
|
(10.1) |
где
V![]() – мольный (молярный) объем продуктов
коррозии (оксида,
хлорида, сульфида и др.);
– мольный (молярный) объем продуктов
коррозии (оксида,
хлорида, сульфида и др.);
V![]() – мольный (молярный) объем металла,
пошедшего на образование оксида;
– мольный (молярный) объем металла,
пошедшего на образование оксида;
М – молярная масса продуктов коррозии;
![]() –плотность
металла;
–плотность
металла;
n – число атомов металла в продукте коррозии;
А – атомная масса металла;
![]() –плотность
продукта коррозии.
–плотность
продукта коррозии.
Если Ф < 1, то образуется пленка, частично покрывающая поверхность металла (рыхлая пленка). Сплошная пленка, обладающая защитным действием, получается лишь при условии 1< Ф < 2,5. Если фактор рыхлости Ф > 2,5, то в пленке возникают напряжения, разрушающие ее и нарушающие сплошность (пленка вспучивается и растрескивается).
Пример
1. При
химической коррозии железа в атмосфере
сухого воздуха, содержащего газообразные
H2S
и O2,
образуются пленки FeS
и FeO.
Напишите уравнения образования этих
соединений. Рассчитайте фактор рыхлости
Ф и сделайте вывод о защитных свойствах
пленок. Плотность ![]() = 7,87;
= 7,87;![]() = 4,7;
= 4,7;![]() = 5,7 г/см
= 5,7 г/см![]() .
.
Решение
Пленки образуются при взаимодействии металла с агрессивной средой в результате следующих реакций:
2Fe
+ 2H2S
+ O![]() = 2FeS + 2H2O;
= 2FeS + 2H2O;
2Fe + O2 = 2FeO.
Подставив числовые значения в (10.1), находим фактор рыхлости:
![]() ,
,
![]() .
.
Поскольку для сульфидной пленки Ф > 2,5, то возможно ее растрескивание и нарушение сплошности.
Критерий Ф для оксидной пленки лежит в интервале 1 < Ф < 2,5. Следовательно, пленка FeO является сплошной и обладает хорошими защитными свойствами.
Электрохимическая коррозия – самопроизвольное разрушение металлов в присутствии электролита в результате образования гальванических пар при контакте разнородных металлов, например запорной арматуры и трубопровода, или множества микрогальванических элементов на поверхности металлического сплава. К числу важнейших типов электрохимической коррозии относится коррозия атмосферная, подземная, в морской и пресной воде, сероводородная, кислотная, щелочная, в расплавленных солях, в водно-органических и органических средах. Основное отличие электрохимической коррозии от химической заключается в пространственном разделении реакций окисления металла и восстановления окислителя, протекающих на катодных и анодных участках. При электрохимической коррозии процессы окисления и восстановления протекают на участках, имеющих различное химическое строение или физическое состояние поверхности, то есть химическую и энергетическую неоднородность. Эта неоднородность может возникать при неодинаковом фазовом и химическом составе металла и сплава, при наличии примесей в металле, при неодинаковой химической обработке, при неодинаковой концентрации окружающего электролита, при неоднородности и разной толщине пленок продуктов коррозии и т. д.
Количественно различную активность поверхностных участков можно охарактеризовать величиной электродного потенциала φ, который возникает на границе «металл – раствор» (табл. 9.1). Более активные участки поверхности имеют меньшее значение электродного потенциала (более отрицательное) и называются анодными участками. Участки с меньшей активностью называются катодными.
На анодных участках происходит окисление металла, то есть его разрушение:
Mе![]() –nē
→ Mе
–nē
→ Mе![]() ,
,
где
Mе![]() – катионы металла, переходящие в
раствор;
– катионы металла, переходящие в
раствор;
Ме0 – металл.
Электроны остаются внутри металла и перемещаются от анодных участков к катодным участкам, с которыми они непосредственно контактируют и на которых происходит восстановление ионов и молекул окислителя, находящихся в коррозионной среде. В зависимости от состава среды протекают следующие процессы:
– в кислой среде:
2Н![]() + 2ē = Н
+ 2ē = Н![]() ;
;
– в нейтральной или слабощелочной среде:
2Н2O
+ 2ē = Н![]() + 2OH
+ 2OH![]() .
.
Наиболее вероятным катодным процессом в нейтральной среде при наличии растворенного в воде воздуха (атмосферная, почвенная коррозия, влажный воздух) является следующий:
O2
+ 2H2O
+ 4ē = 4OH![]() .
.
Пример 2. Составьте электронные уравнения катодного и анодного процессов коррозии железного сплава с никелем в соляной кислоте и во влажном воздухе. Каков состав продукта коррозии?
Решение
Выпишем
из таблицы 9.1 значения стандартных
электродных потенциалов металлов: φ0![]() =
–0,44 В, φ0
=
–0,44 В, φ0![]() = –0,25 В. Поскольку φ0
= –0,25 В. Поскольку φ0![]() < φ0
< φ0![]() ,
то железо будет выполнять функцию
анода, а никель – катода.
,
то железо будет выполнять функцию
анода, а никель – катода.
В кислой среде электронные уравнения процессов имеют вид:
– анодная реакция: Fе0 – 2ē = Fе2+;
– катодная реакция: 2Н+ + 2ē = Н02.
Продуктами
коррозии являются хлорид железа FeCl![]() и водород.
и водород.
Во влажном воздухе на катодном и анодном участках происходят следующие реакции:
– анодная
реакция: Fе![]() – 2ē =Fе
– 2ē =Fе![]() ;
;
– катодная
реакция: 2Н![]() O
+ O
O
+ O![]() + 4ē = 4OH
+ 4ē = 4OH![]() .
.
Продукты
коррозии Fе![]() + 2OH
+ 2OH![]() = Fе(OH)
= Fе(OH)![]() .
.
В присутствии влаги и кислорода происходит дальнейшее окисление железа до трехвалентного состояния:
4Fе(OH)![]() + 2Н
+ 2Н![]() O
+ O
O
+ O![]() = 4Fе(OH)
= 4Fе(OH)![]() .
.
Для количественной оценки коррозионной стойкости металлов используют массовый (j) и глубинный (П) показатели.
Скорость химической реакции определяется из соотношения:
|
|
|
(10.2) |
где ∆m – изменение массы образца, г;
![]() –время
коррозии, час или год;
–время
коррозии, час или год;
S – площадь поверхности коррозии, м2.
Глубинный показатель коррозии П равен:
|
|
П
=
|
(10.3) |
где ∆h – толщина металла, разрушенного в течение времени .
Величины П и j связаны соотношением:
![]() ,
если j
измеряется в г/м2.год,
,
если j
измеряется в г/м2.год,
или
![]() ,
если j
измеряется в г/м2.ч,
,
если j
измеряется в г/м2.ч,
где – плотность металла, г /см3.
По вышеприведенным показателям оценивается, как правило, общая коррозия системы.

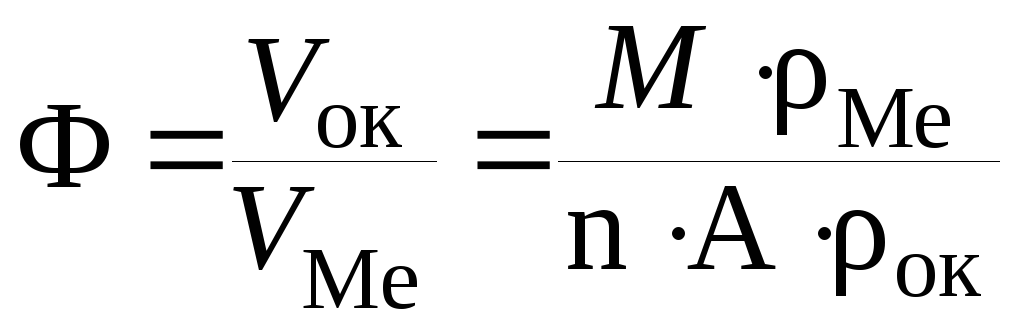 ,
,