
- •Росжелдор
- •Введение: основные понятия и определения
- •Основы номенклатуры неорганических соединений можно изложить следующим образом:
- •1 Классы неорганических соединений
- •Растворимость солей, кислот и оснований в воде
- •2 Химическая термодинамика
- •3 Скорость химических реакций
- •3.1 Количественное определение скорости химической реакции
- •3.2 Влияние катализатора
- •4 Химическое равновесие
- •4.1 Понятие о химическом равновесии
- •4.2 Динамический характер и устойчивость химического равновесия
- •4.3 Константа химического равновесия
- •4.4 Положение равновесия и его зависимость от внешних факторов
- •4.4.1 Зависимость равновесия от концентрации
- •4.4.2 Зависимость равновесия от температуры
- •4.4.3 Влияние давления на равновесие
- •4.4.4 Влияние катализатора на равновесие
- •В выражение константы равновесия входят равновесные концентрации веществ:
- •5 Строение электронных оболочек атомов. Периодический закон д.И. Менделеева
- •6 Химическая связь и строение молекул
- •7 Растворы
- •7.1 Способы выражения концентрации растворов
- •7.2 Физико-химические свойства разбавленных растворов неэлектролитов. Давление пара растворов. Закон Рауля
- •7.2.1 Понижение температуры замерзания и повышение температуры кипения растворов (следствия из закона Рауля)
- •7.3 Растворы электролитов
- •7.4 Ионное произведение воды. Водородный показатель рН
- •8 Окислительно-восстановительные реакции
- •9 Гальванические элементы
- •9.1 Понятие об электродном потенциале
- •9.2 Гальванический элемент
- •10 Коррозия металлов
- •10.1 Защита от коррозии
- •11 Электролиз
- •11.1 Катодные процессы
- •11.2 Анодные процессы
- •12 Полимеры
- •12.1 Реакция полимеризации
- •12.2 Реакция поликонденсации
- •12.3 Полимерные материалы
- •13 Дисперсные системы
- •14 Химический анализ
- •Библиографический список
- •Содержание
- •Мигаль Юрий Фёдорович
10.1 Защита от коррозии
Поскольку, как отмечалось выше, процесс электрохимической коррозии заключается в протекании взаимосвязанных катодной и анодной реакций, то замедление одной из них приводит к снижению скорости коррозионного процесса в целом.
Методы защиты от коррозии можно разделить на три группы:
– воздействие на металл;
– воздействие на агрессивную среду;
– комбинированные методы защиты.
К первой группе относятся:
а) легирование металлов – создание экранирующего поверхностного слоя или введение элементов, понижающих катодную или анодную активность сплава;
б) обработка поверхности металла – термическая обработка, напыление, механическая обработка (наклеп и т. п.), модифицирование ржавчины на поверхности;
в) нанесение защитных покрытий;
г) подбор коррозионно-стойких материалов;
д) рациональное конструирование – вывод отдельных узлов конструкции из агрессивных сред.
Вторая группа методов защиты включает:
а) применение ингибиторов коррозии;
б) деаэрация среды;
в) создание искусственных сред (обработка водных сред, применение нейтральных сред, осушение воздуха).
Третья группа методов защиты использует комбинацию вышеперечисленных методов.
Защитные покрытия можно подразделить на органические (битум, краски, эмали, лаки), неорганические (оксидные, фосфатные, нитридные и другие пленки) и гальванические (металлические, полученные путем электролиза).
Неорганические (химические) покрытия получают обработкой металла определенными химическими веществами. При взаимодействии этого вещества с поверхностью металла образуется пленка прочного неорганического соединения, которая предохраняет металл от разрушения.
Гальванические
покрытия
делятся на катодные и анодные (рис.
10.1) в зависимости от соотношения
стандартных электродных потенциалов
защищаемого материала 0![]() и покрытия0
и покрытия0![]() .
Если0
.
Если0![]() >0
>0![]() ,
то при нарушении целостности защитного
покрытия анодом будет металл покрытия
(анодное
покрытие),
катодом – защищаемый металл.
,
то при нарушении целостности защитного
покрытия анодом будет металл покрытия
(анодное
покрытие),
катодом – защищаемый металл.
Анодное
покрытие очень эффективно, так как оно,
разрушаясь, предохраняет защищаемый
металл от разрушения. Примером анодного
покрытия по отношению к железу являются
цинковые и магниевые покрытия сталей.
Если 0![]() <0
<0![]() ,
то при нарушении целостности покрытия
защищаемый металл будет анодом, а металл
покрытия – катодом (катодное
покрытие).
Катодные покрытия защищают металл до
тех пор, пока эти покрытия будут
сплошными.
,
то при нарушении целостности покрытия
защищаемый металл будет анодом, а металл
покрытия – катодом (катодное
покрытие).
Катодные покрытия защищают металл до
тех пор, пока эти покрытия будут
сплошными.
среда среда

Рис. 10.1. Гальванические покрытия: а) анодное покрытие 01 > 02; б) катодное покрытие 01 < 02. Ме1 – защищаемый металл, Ме2 – металл покрытия (А – анод, В – катод)
Электрохимическая защита подразделяется на катодную, протекторную и анодную. Первые два вида электрохимической защиты осуществляются с помощью создания гальванического элемента, в котором роль катода выполняет защищаемый металл. Это достигается с помощью контакта его с более активным металлом – протектором (имеющим меньшее значение стандартного электродного потенциала) или подключения изделия к отрицательному полюсу внешнего источника тока (катодная защита).
Анодная защита происходит при подключении металла к положительному полюсу источника тока и формированию на его поверхности прочного оксидного слоя за счёт анодного окисления под действием электролиза (и смещении его электродного потенциала в область пассивного состояния).
Ингибиторами называют добавляемые в небольших количествах в агрессивную среду вещества, которые накапливаются на границе «металл – электролит» и снижают скорость коррозии. Эффективность действия ингибиторов оценивается величинами коэффициента торможения К и степени защиты Z:
![]()
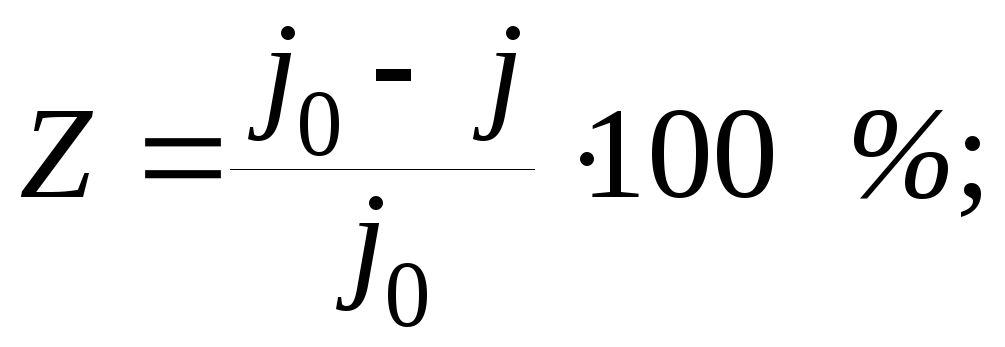
где
ј![]() – скорость коррозии в растворе без
ингибитора;
– скорость коррозии в растворе без
ингибитора;
ј – скорость коррозии в растворе с ингибитором.
Величина К показывает, во сколько раз снижается скорость коррозии металла при введении ингибитора. Величина Z характеризует относительное понижение скорости коррозии. На защитное действие ингибиторов существенное влияние оказывает ряд внешних и внутренних факторов коррозии: кислотность среды, температура, природа кислоты и защищаемого материала, природа растворителя и самого ингибитора, концентрация ингибитора, перемешивание и др.
Пример 3. Можно ли использовать цинковое покрытие для защиты стального изделия от коррозии во влажном воздухе? Составьте электронные уравнения катодного и анодного процессов коррозии, наблюдаемой при нарушении этого покрытия. Каков состав продуктов коррозии? Какой должна быть толщина покрытия, чтобы оно прослужило 5 лет, если величина его глубинного показателя П равна 0,16 мм/год? Покрытие считается недействующим, если его остаточная толщина составляет 18 % от первоначального значения.
Решение
Сопоставляя электродные потенциалы 0Zn/Zn2+ = –0,76 В и 0Fe/Fe2+= –0,44 В, видим, что 0Zn < 0Fe .Следовательно, цинк по отношению к железу является анодом. Цинковое покрытие – анодное покрытие. На аноде идет процесс окисления:
Zn – 2ē = Zn2+.
На катоде (Fe) – процесс восстановления частиц среды (во влажном воздухе это кислород и вода):
2Н![]() O
+ O
O
+ O![]() + 4ē = 4OH
+ 4ē = 4OH![]() .
.
Продукты коррозии: Zn2+ + 2OH- = Zn(OH)2.
При нарушении покрытия сталь не растворяется, следовательно, цинковое покрытие использовать можно.
Толщину покрытия ∆h можно найти из уравнения:
![]() ,
мм/год,
,
мм/год,
откуда ∆h = П = 0,16.5 = 0,8 мм.
Но коррозии подвержено 82 % первоначальной толщины. Тогда вся толщина покрытия должна быть равна 100 %:
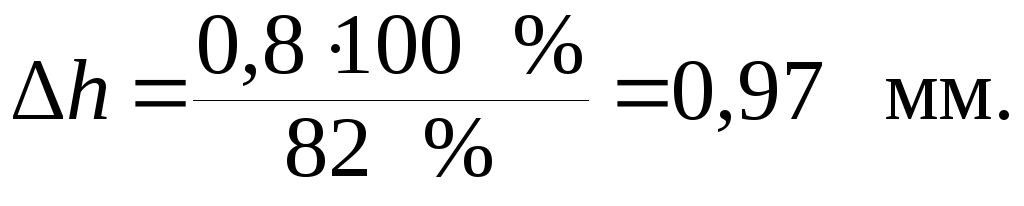
Задачи
251–255 Составьте электронные уравнения анодного и катодного процессов коррозии стального трубопровода (основной компонент стали – железо), содержащего примеси металла А, во влажной почве (присутствуют вода и кислород). Каков состав продуктов коррозии? Рассчитайте толщину стенок трубопровода (мм), который должен прослужить τ лет, если скорость его коррозии равна j. Остаточная толщина стенок трубопровода должна быть не меньше 25 % от первоначального значения. Плотность железа = 7,87 г/см3.
|
№ задачи |
Примесь А |
j, кг/м2год |
, лет |
Ответ, мм |
|
251 |
Ni |
3,305 |
15 |
8,4 |
|
252 |
Sn |
6,558 |
6 |
6,67 |
|
253 |
Pb |
4,984 |
6 |
5,07 |
|
254 |
Cu |
1,695 |
13 |
3,73 |
|
255 |
Sb |
6,690 |
4 |
4,53 |
256–259 Можно ли использовать предлагаемый материал в качестве протектора для защиты стального изделия от коррозии в природной воде, насыщенной кислородом (основной компонент стали – железо)? Составьте электронные уравнения анодного и катодного процессов коррозии. Каков состав продуктов коррозии? Определите возможный срок службы протектора сечением «ав», если скорость его коррозии j, г/м2год, а масса m, г.
|
№ задачи |
Материал протектора |
а, см |
в, см |
j, г/м2год |
m, г |
Ответ |
|
256 |
Zn |
200 |
50 |
5 |
20 |
4 |
|
257 |
Al |
100 |
50 |
2,5 |
15 |
12 |
|
258 |
Mg |
100 |
100 |
10 |
30 |
3 |
|
259 |
Zn-Hg |
200 |
70 |
2 |
25 |
8,9 |
260–262 Можно ли использовать предполагаемое покрытие для эффективной защиты стального изделия от коррозии во влажном воздухе? (Основной компонент стали – железо.)
Составьте электронные уравнения анодного и катодного процессов коррозии, возникающей при нарушении целостности покрытия. Каков состав продуктов коррозии? Какой должна быть толщина покрытия, чтобы оно прослужило τ лет, если величина его глубинного показателя П, мм/год? Покрытие считается действующим до тех пор, пока его остаточная толщина не составит 15 % от первоначального значения.
|
№ задачи |
Материал покрытия |
П, мм/год |
, лет |
Ответ, мм |
|
260 |
Mg |
4 |
0,7 |
3,3 |
|
261 |
Zn |
5 |
0,3 |
1,76 |
|
262 |
Al |
5 |
0,6 |
3,53 |
263–266 При химической коррозии металлов Ме в атмосфере сухого воздуха, содержащего газообразные O2; HCl; H2S, под воздействием высоких температур образуются пленки продуктов коррозии. Напишите уравнения образования соединений. Зная плотности металлов, их оксидов, хлоридов, сульфидов, определите, какие из пленок будут обладать защитным действием.
|
№ задачи |
Металл, Ме |
|
Продукты коррозии и их плотности, г/см3 |
|
263 |
Fe |
7,87 |
FeO –5,7; Fe2O3 –5,25; FeCl2 – 2,9; FeS2 – 5,03; Fe3O4 – 5,18 |
|
264 |
Cu |
8,94 |
CuO – 6,46; Cu2O – 3,7; CuCl2 – 3,05; Cu2S – 5,4; CuS – 4,68 |
|
265 |
Mn |
7,74 |
MnO –5,18; Mn2O3 – 4,3; Mn3O4 – 7,42; MnCl2 – 2,98; MnO2 – 5,03 |
|
266 |
Ni |
8,91 |
NiO – 7,45; Ni2S3 – 5,82; NiCl2 – 3,51; NiS – 4,12 |
267–270 Металлическое изделие, содержащее примесные включения А (см. таблицу), сильно корродирует в растворе HCl. Для замедления процесса в растворах кислот используют ингибиторы. Определите коэффициент торможения коррозии К и степень защиты Z, которые обеспечивает ингибитор, если за часов потери массы изделия площадью S составляют m0 граммов в отсутствие ингибитора и m граммов при его наличии. Составьте электронные уравнения анодного и катодного процессов коррозии изделия в кислоте. Каков состав продуктов коррозии?
|
№ задачи |
Металл изделия |
Примесь |
(час) |
S (м2) |
m0 (г) |
m (г) |
|
267 |
Fe |
Cd |
24 |
100 |
3360 |
960 |
|
268 |
Fe |
Ni |
80 |
120 |
5665 |
70,8 |
|
269 |
Zn |
Bi |
25 |
85 |
1085 |
339 |
|
270 |
Cr |
Sn |
168 |
105 |
950 |
95 |
Ответ: 267) 3,5; 71,2 %; 268) 8,0; 87,6 %; 269) 8,0; 87,6 %; 270) 2,6; 61,6 %.
