
- •Росжелдор
- •Введение: основные понятия и определения
- •Основы номенклатуры неорганических соединений можно изложить следующим образом:
- •1 Классы неорганических соединений
- •Растворимость солей, кислот и оснований в воде
- •2 Химическая термодинамика
- •3 Скорость химических реакций
- •3.1 Количественное определение скорости химической реакции
- •3.2 Влияние катализатора
- •4 Химическое равновесие
- •4.1 Понятие о химическом равновесии
- •4.2 Динамический характер и устойчивость химического равновесия
- •4.3 Константа химического равновесия
- •4.4 Положение равновесия и его зависимость от внешних факторов
- •4.4.1 Зависимость равновесия от концентрации
- •4.4.2 Зависимость равновесия от температуры
- •4.4.3 Влияние давления на равновесие
- •4.4.4 Влияние катализатора на равновесие
- •В выражение константы равновесия входят равновесные концентрации веществ:
- •5 Строение электронных оболочек атомов. Периодический закон д.И. Менделеева
- •6 Химическая связь и строение молекул
- •7 Растворы
- •7.1 Способы выражения концентрации растворов
- •7.2 Физико-химические свойства разбавленных растворов неэлектролитов. Давление пара растворов. Закон Рауля
- •7.2.1 Понижение температуры замерзания и повышение температуры кипения растворов (следствия из закона Рауля)
- •7.3 Растворы электролитов
- •7.4 Ионное произведение воды. Водородный показатель рН
- •8 Окислительно-восстановительные реакции
- •9 Гальванические элементы
- •9.1 Понятие об электродном потенциале
- •9.2 Гальванический элемент
- •10 Коррозия металлов
- •10.1 Защита от коррозии
- •11 Электролиз
- •11.1 Катодные процессы
- •11.2 Анодные процессы
- •12 Полимеры
- •12.1 Реакция полимеризации
- •12.2 Реакция поликонденсации
- •12.3 Полимерные материалы
- •13 Дисперсные системы
- •14 Химический анализ
- •Библиографический список
- •Содержание
- •Мигаль Юрий Фёдорович
14 Химический анализ
Химический анализ – это совокупность методов, с помощью которых определяют химический состав веществ. Химический анализ разделяют на качественный и количественный.
Задача качественного анализа – идентификация веществ, т. е. обнаружение наличия химических элементов в соединениях или химических соединений в смесях. Задача количественного анализа – определение количеств элементов или их соединений в исследуемом веществе.
Химический анализ – сложный многостадийный процесс, состоящий из нескольких этапов: отбор пробы, выбор метода анализа, подготовка пробы к анализу, проведение измерений, обработка результатов измерений.
Одно из ключевых понятий химического анализа – аналитический сигнал, который представляет собой экспериментальную информацию о качественном и количественном составе исследуемого вещества.
Методы идентификации веществ основаны на получении аналитического сигнала в результате проведения химической реакции. Определяемый ион или элемент переводят в другое химическое соединение, обладающее характерными свойствами (выпадение осадка, выделение газа, изменение окраски и т. д.). Данные изменения указывают на присутствие того или иного иона (элемента, групп ионов) в пробе. При проведении качественного анализа используют систематический и дробный методы. Систематический метод основан на разделении смеси ионов на группы и подгруппы с помощью групповых реагентов. Дробный метод основан на определении данного элемента или иона в анализируемом образце с помощью качественной реакции (см. табл. 14.1 и 14.2).
При проведении количественного анализа аналитическим сигналом является физическая величина, функционально связанная с содержанием компонента. По величине этого сигнала (массе осадка, силе тока, интенсивности линий спектра и т. д.) рассчитывают содержание компонента в исследуемом образце.
Для количественного определения концентраций (количеств) химических элементов (соединений) и их форм в анализируемом образце используют методы химические и инструментальные (физико-химические и физические). К химическим методам относятся гравиметрический (весовой) анализ и волюмометрический (объемный) анализ. Волюмометрические методы в зависимости от агрегатного состояния вещества делятся на газоволюмометрические, основанные на измерении объема газа, и титриметрические, основанные на измерении объема жидкого реагента (титранта) с известной концентрацией, взаимодействующего с определяемым веществом
Таблица 14.1
Качественные реакции на катионы
|
Катион |
Реактив |
Аналитический признак реакции |
|
K+ |
Кобальтонитрит натрия Na3[Co(NO2)6] в нейтральной или уксуснокислой среде |
Жидкий кристаллический осадок K2Na[Co(NO2)6] |
|
Гидротартрат натрия (NaHC4H4O6) в нейтральной среде при охлаждении |
Белый кристаллический осадок гидротартрата калия | |
|
Действие на пламя |
Фиолетовое окрашивание, видимое через кобальтовое стекло | |
|
Na+ |
Ацетат уранила UO2(CH3COO)2 в уксуснокислой среде |
Зеленовато-желтый кристаллический осадок двойной соли |
|
Дигидроантимонат калия в нейтральной или слабощелочной среде |
Белый кристаллический осадок дигидроантимоната натрия | |
|
Действие на пламя |
Желтое окрашивание | |
|
NH4+ |
Едкая щелочь при нагревании |
Выделяется аммиак, который обнаруживают по посинению лакмусовой бумаги или по почернению фильтровальной бумаги, пропитанной раствором ртути (II) |
|
Реактив Несслера (смесь растворов K2[HgI4] и KOH) |
Красно-бурый осадок NH2Hg2I3 | |
|
Ba2+ |
Хромат калия (K2CrO4) в уксуснокислой среде или бихромат калия (K2Cr2O7) при добавлении ацетата натрия |
Светло-желтый осадок хромата бария |
|
Действие на пламя |
Желто-зеленое окрашивание | |
|
Ca2+ |
Оксалат аммония (NH4)2C2O4 в уксуснокислой среде |
Белый кристаллический осадок |
|
Действие на пламя |
Кирпично-красное окрашивание | |
|
Al3+ |
Ализарин красный S в слабокислой среде при отсутствии катионов железа (III) |
Красный осадок или красное окрашивание |
|
Едкая щелочь в избытке хлорида аммония (кипячение) |
Белый осадок гидроксида алюминия | |
|
F |
Феррицианид калия
K |
Темно-синий осадок феррицианида
Окончание табл. 14.1 железа (II) (турнбулева синь) |
|
Катион |
Реактив |
Аналитический признак реакции |
|
Fe3+ |
Ферроцианид калия K4[Fe(CN)6] (желтая кровяная соль) |
Темно-синий осадок ферроцианида железа (III) (берлинская лазурь) |
|
Роданид калия (KSCN) или роданид аммония (NH4CNS) |
Кроваво-красное окрашивание | |
|
Zn2+ |
Сероводород (H2S) при pH = 2,5 |
Белый осадок сульфида цинка |
|
Ag+ |
Соляная кислота (HCl) |
Белый осадок, растворимый в аммиаке и нерастворимый в азотной кислоте |
|
Pb2+ |
Йодид калия (KI) |
Желтый осадок йодида свинца, растворимый в горячей воде |
|
Серная кислота (H2SO4) |
Белый осадок, растворимый в щелочи | |
|
Cu2+ |
Избыток аммиака |
Раствор темно-синего цвета – аммиакат меди |
|
Желтая кровяная соль K4[Fe(CN)6] и соляная кислота (HCl) |
Кроваво-красный осадок |
Гравиметрический метод основан на точном измерении массы определяемого компонента пробы анализируемого вещества, выделенного в виде соединения определенного состава. Гравиметрическое определение методом осаждения проводят в несколько этапов. Навеску анализируемого вещества растворяют, после чего определяемый элемент осаждают в виде какого-либо малорастворимого соединения, называемого осаждаемой формой. Выпавший осадок отделяют фильтрованием, тщательно промывают и прокаливают. Полученную так называемую гравиметрическую форму взвешивают, и по массе осадка и его химической формуле рассчитывают массовую долю ω определяемого компонента в анализируемом веществе:
|
|
|
(14.1) |
где m1 – масса навески вещества, взятого для анализа;
m2 – масса гравиметрической формы;
F – гравиметрический фактор.
Гравиметрическим фактором называют отношение молярной массы M1 определяемого компонента к молярной массе M2 гравиметрической формы.
Таблица 14.2
Качественные реакции на анионы
|
Анион |
Реактив |
Аналитический признак реакции |
|
Cl– |
Нитрат серебра в азотно-кислой среде |
Белый осадок хлорида серебра, растворимый в избытке аммиака |
|
Br– |
Хлорная вода
|
Окисление бромид-иона до Br2, который окрашивает органический растворитель в желтый цвет |
|
I– |
Хлорная вода или нитрат калия |
Окисление йодид-иона до I2, который окрашивает крахмал в синий цвет, а органический растворитель в красно-фиолетовый |
|
CO32– |
Разбавленные кислоты |
Выделение CO2 обнаруживается по помутнению известковой воды |
|
SO42– |
Хлорид бария |
Белый осадок, нерастворимый в азотной кислоте |
|
PO43– |
Магнезиальная смесь (MgCl2 + NH4OH + NH4Cl) |
Белый осадок
|
|
NO3– |
Дифениламин |
Синее окрашивание |
Пример 1
Рассчитайте массу навески апатито-нефелиновой руды, содержащей 30 % Р2О5, необходимую для получения 0,901 г осадка (NH4)3PO4∙12MoO3.
Решение
Из уравнения (14.1) выразим массу навески руды:
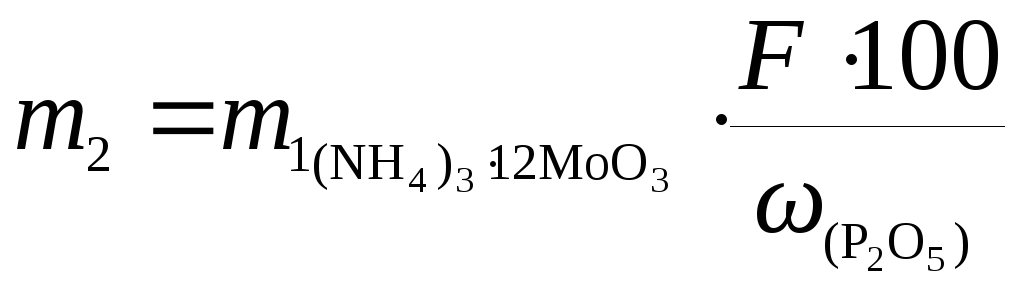 ;
;
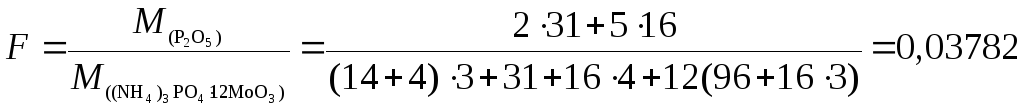 ;
;
 .
.
Ответ: масса навески должна составлять 0,114 г.
(Массу навески рассчитывают с точностью трех знаков после запятой, а взвешивают образец с обычной аналитической точностью до четвертого знака после запятой.)
Титриметрический метод анализа основан на измерении объёма титранта, израсходованного на реакцию с анализируемым веществом. В процессе титрования к точно отмеренному объёму (VA) раствора анализируемого вещества А небольшими порциями приливают раствор титранта В с концентрацией СВ. Уравнение реакции в общем виде:
mA + nB = pC + qD ,
где А – анализируемое вещество;
В – титрант;
С и D – продукты реакции;
m, n, p, q – стехиометрические коэффициенты.
По мере протекания реакции равновесные концентрации анализируемого вещества А и титранта В уменьшаются, а равновесные концентрации продуктов реакции С и D увеличиваются. Реакция закончится, когда будет израсходовано количество титранта В, эквивалентное количеству титруемого вещества А. Этот момент титрования называют точкой эквивалентности (Т.Э.). В химических методах точку эквивалентности фиксируют визуально по заметному аналитическому эффекту (резкому изменению окраски раствора или специально введенного индикатора, выпадению осадка и т. д.). В физикохимических методах анализа точку эквивалентности определяют по резкому изменению измеряемого физического параметра (рН, потенциала, электропроводности раствора и т. д.). Определив объем титранта В в точке эквивалентности (VВ), можно рассчитать неизвестную концентрацию анализируемого вещества (СА) по закону эквивалентов: вещества реагируют в количествах, пропорциональных их эквивалентам. Для реакций в растворах закон эквивалентов имеет вид:
|
|
|
(14.2) |
Отсюда концентрация анализируемого вещества равна:
|
|
|
(14.3) |
Физико-химические методы анализа основаны на проведении аналитических реакций, окончание которых определяется с помощью приборов. Поэтому такие методы относят к инструментальным. Приборы фиксируют изменение физического свойства анализируемого вещества или его раствора (оптической плотности, электропроводности, тока поляризации катода, количества электричества, израсходованного на электролиз, и т. д.).
К физико-химическим методам относятся электрохимические методы (потенциометрия, полярография, кондуктометрия, электрогравиметрия и т. д.), оптические методы (колориметрия, фотоколориметрия, спектрофотометрия и т. д.), хроматография и т. д.
При потенциометрическом титровании определение точки эквивалентности основано на измерении потенциала индикаторного электрода относительно электрода сравнения в ходе титрования, например, сильной кислоты сильным основанием. Для определения точки эквивалентности достаточно следить только за концентрацией ионов водорода (Н+). В качестве индикаторного электрода часто используют стеклянный электрод, потенциал которого зависит от концентрации Н+ и не зависит от присутствия в растворе других ионов. Электродом сравнения обычно является хлорсеребряный электрод, потенциал которого постоянен и не зависит от концентрации Н+.
Графическим представлением изменения рН в процессе титрования является кривая титрования, которая отражает зависимость рН анализируемого раствора от объема добавленного титранта. По кривой титрования определяют объем добавленного титранта в точке эквивалентности. Для этого к плечам кривой титрования проводят касательные, при пересечении которых образуются точки А и В (рис. 14.1). При делении расстояния АВ пополам получают точку С, из которой опускают перпендикуляр на ось абсцисс. Найденный объём равен объему титранта в точке эквивалентности.
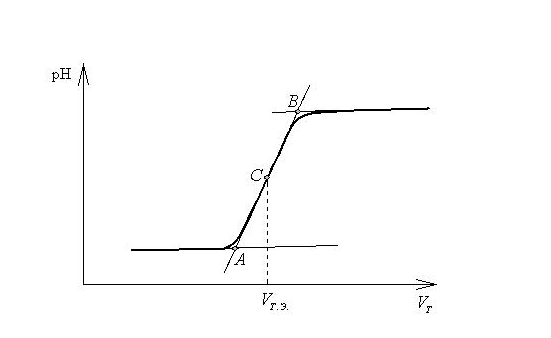
Рис. 14.1. Определение точки эквивалентности
Полученный объем подставляют в уравнение закона эквивалентов (14.2) и рассчитывают концентрацию раствора анализируемого вещества.
Пример 2
Постройте кривую потенциометрического титрования рН = f(VHCl), если при титровании 20 мл раствора метиламина CH3NH2 0,1 M раствором HCl получены данные:
|
VКОН, мл |
10,0 |
13,0 |
14,0 |
14,5 |
15,0 |
15,5 |
16,0 |
17,0 |
|
рН |
5,15 |
5,16 |
5,5 |
6,79 |
8,38 |
9,5 |
10,5 |
11,1 |
Рассчитайте концентрацию раствора метиламина.
Решение
Построим кривую титрования и проведем касательные к плечам кривой титрования.
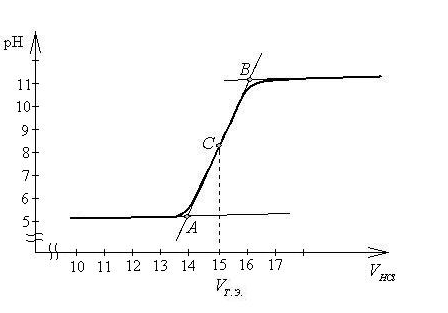
Разделив расстояние АВ между точками пересечения касательных А и В пополам, получим точку С. Опустим перпендикуляр из точки С на ось абсцисс и определим объём HCl в точке эквивалентности (VHCl = 15 мл). Подставив найденное значение VHCl в уравнение (14.3), рассчитаем концентрацию раствора метиламина:

Ответ: концентрация метиламина в растворе равна 7,5∙10–2 моль/л.
При кондуктометрическом титровании точку эквивалентности определяют по изменению удельной электропроводности раствора анализируемого вещества А. Электропроводность – величина, обратная электрическому сопротивлению R и измеряемая в Ом–1 или См (сименсах). Сопротивление раствора прямо пропорционально расстоянию между электродами d и обратно пропорционально площади их поверхности S:
|
|
|
(14.4) |
где![]() – удельноесопротивление
(Ом∙см).
– удельноесопротивление
(Ом∙см).
Удельная электропроводность – величина, обратная удельному сопротивлению и измеряемая в См∙см–1:
|
|
= 1/. |
(14.5) |
При кондуктометрическом титровании измеряют электропроводность анализируемого раствора А после добавления небольших порций титранта В и находят точку эквивалентности графическим методом с помощью кривой титрования = f (VB) (VB – объём добавленного титранта В). На рисунке 14.2 представлена кривая кондуктометрического титрования и способ нахождения объема титранта в точке эквивалентности.
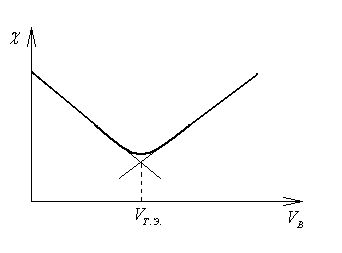
Рис. 14.2. Определение точки эквивалентности
Определив объем титранта в точке эквивалентности, рассчитывают концентрацию раствора анализируемого вещества по формуле (14.2).
Пример 3
При кондуктометрическом титровании 50 мл хлороводородной кислоты 0,01 н раствором едкого натра получили следующие данные:
-
VNaOH, мл
0
2
4
6
8
10
 ,
м∙см-1
,
м∙см-11,500
1,090
0,672
0,633
0,991
1,35
Постройте кривую титрования = f(VNaOH) и определите точку эквивалентности. Рассчитайте нормальную концентрацию раствора HCl.
Решение
Построим кривую кондуктометрического титрования и с помощью касательных определим точку эквивалентности.
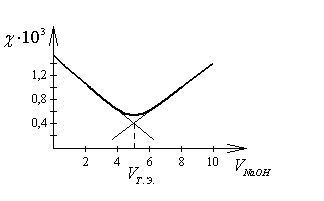
Объём раствора NaOH в точке эквивалентности равен 5 мл. Подставим это значение в уравнение (14.2) и получим значение концентрации HCl:

Ответ:
концентрация хлороводородной кислоты
в растворе равна
![]() .
.
Полярографический метод анализа основан на электролизе растворов солей с использованием ртутного капающего катода. Анодом является металлическая ртуть, находящаяся на дне полярографической ячейки. Изменение внешней ЭДС полностью идет на изменение потенциала катода. В присутствии солей в анализируемом растворе ионы металлов при достижении потенциала восстановления разряжаются на ртутном катоде:
Mn+ + nē + Hg = M0(Hg).
Сила тока в цепи увеличивается, а концентрация восстанавливающихся ионов у поверхности ртутной капли (катода) уменьшается. При некотором потенциале катода концентрация у поверхности ртутной капли станет значительно меньше, чем концентрация в массе раствора, а скорость восстановления катионов металла на катоде станет равной скорости диффузии катионов к катоду объема раствора. Это состояние равновесия характеризуется постоянной силой тока, не изменяющейся при дальнейшем увеличении напряжения. Постоянный ток, зависящий от скорости диффузии, называется диффузионным током Id. Потенциал ртутного катода (Е) выражается уравнением:
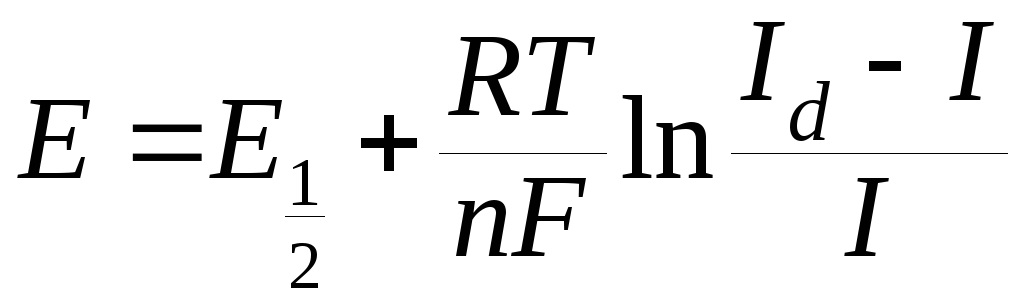 ,
,
где
![]() – потенциал
полуволны, при котором ток равен половине
диффузионного тока;
– потенциал
полуволны, при котором ток равен половине
диффузионного тока;
Id – диффузионный ток;
I – сила тока в цепи.
Данное уравнение называется уравнением полярографической волны, определяющим зависимость тока от приложенного напряжения в обратимом электродном процессе. Графическая зависимость силы тока от напряжения называется полярограммой (рис. 14.3).
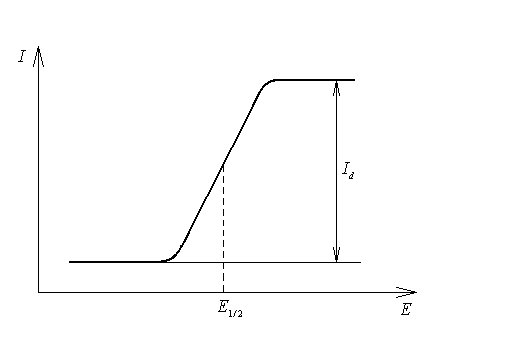
Рис. 14.3. Вид полярограммы
По
величине потенциала полуволны![]() проводят качественный анализ вещества,
а по высоте полярографической волны,
равнойId,
определяют концентрацию раствора
анализируемого вещества.
проводят качественный анализ вещества,
а по высоте полярографической волны,
равнойId,
определяют концентрацию раствора
анализируемого вещества.
Связь диффузионного тока с концентрацией ионов металла описывается уравнением Ильковича:
|
|
|
(14.6) |
где z – заряд иона металла;
D – коэффициент диффузии;
m – масса ртути, вытекающей из капилляра в 1 с;
t – время образования капли;
СМ – молярная концентрация анализируемого раствора.
При постоянных условиях полярографирования D, m, t постоянны, и поэтому:
|
|
|
(14.7) |
Линейная зависимость Id от концентрации определяемого иона является основой количественного полягрофического анализа.
По данным полярографирования ряда стандартных растворов строят градуировочный график в координатах: высота полярогрофической волны h – концентрация анализируемого вещества (рис. 14.4).
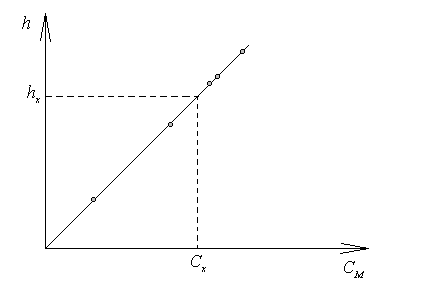
Рис. 14.4. Зависимость высоты полярографической волны от концентрации
Полярографируя раствор с неизвестной концентрацией, по полученному значению высоты hx определяют Сх , используя градуировочный график.
Пример 4
Для построения градуировочного графика записали полярограммы и измерили высоту полягрофической волны hx (мм).
|
|
0,50 |
1,00 |
1,50 |
2,00 |
|
hx, мм |
9,0 |
17,5 |
26,2 |
35,5 |
Навеску латуни массой 0,1200 г растворили и раствор разбавили до 50 мл. Рассчитайте массовую долю меди в анализируемом образце, если высота полягрофической волны hx равна 23 мм.
Решение
Построим
градуировочный график в координатах
![]()
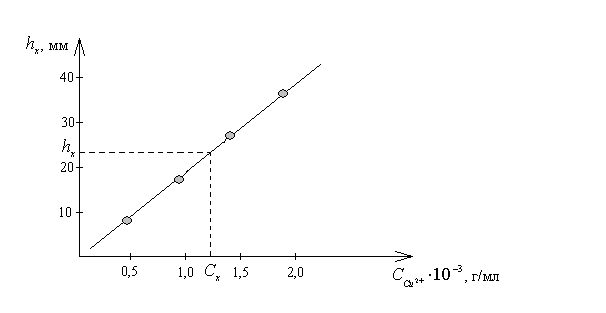
По
графику находим
![]() г/мл,
соответствующуюhx
= 23,0 мм,
и рассчитываем массовую долю (%) меди в
образце латуни.
г/мл,
соответствующуюhx
= 23,0 мм,
и рассчитываем массовую долю (%) меди в
образце латуни.
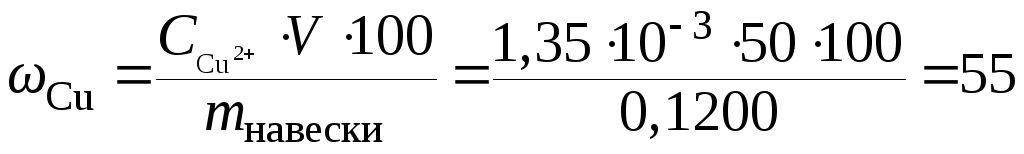 %.
%.
Фотоколориметрический метод – это инструментальный метод количественного анализа, основанный на измерении интенсивности светового потока, прошедшего через раствор вещества.
При прохождении монохроматического потока излучения с интенсивностью I0 через слой l гомогенного раствора вещества часть его отражается, часть поглощается и часть проходит через этот слой.
Согласно закону Бугера – Ламберта – Бера зависимость между интенсивностями падающего светового потока и прошедшего через поглощающий слой от концентрации поглощающего раствора имеет вид:
|
|
|
(14.8) |
где I0 – интенсивность падающего светового потока;
I – интенсивность светового потока, прошедшего через поглощающий слой;
![]() –молярный
коэффициент светопоглощения;
–молярный
коэффициент светопоглощения;
l – толщина поглощающего слоя;
С – концентрация поглощающего раствора вещества.
Десятичный логарифм отношения I0 к I называется оптической плотностью раствора и обозначается буквой D:
|
|
|
(14.9) |
Следовательно:
|
|
|
(14.10) |
При постоянной величине l (например, l = 1 см) оптическая плотность прямо пропорциональна концентрации раствора вещества:
![]()
В фотоколориметрическом методе измерение поглощения световых потоков проводят с помощью фотоэлементов. Для определения концентрации исследуемого раствора строят градуировочную кривую, которая служит для графического нахождения концентрации исследуемого раствора по его оптической плотности. Градуировочная кривая строится по результатам измерения оптической плотности серии стандартных растворов исследуемого вещества D = f(Ср-ра). Измерив оптическую плотность раствора с неизвестной концентрацией Dх, по полученному градуировочному графику находят неизвестную Сх
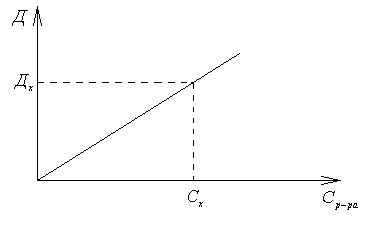
Пример 5
По результатам измерений оптической плотности серии стандартных растворов KMnO4 при = 533 нм, приведенным в таблице, постройте градуировочный график, с помощью которого определите концентрацию раствора перманганата калия, если его оптическая плотность (Dх) составила 0,390.
|
|
1,0910–5 |
1,6410–5 |
2,1810–5 |
|
D |
0,230 |
0,350 |
0,470 |
Решение
По табличным данным построим график D = f(C):
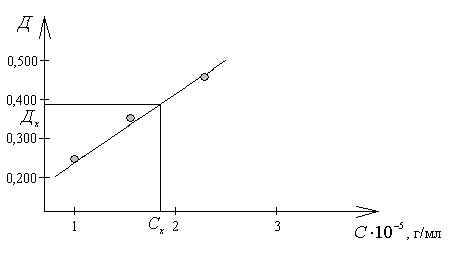
По графику находим Сх, соответствующую оптической плотности (0,390) раствора с неизвестной концентрацией. Эта концентрация равна 1,85∙10 –5 г/мл.
Задачи
341–344 При кислотно-основном титровании 20 мл раствора вещества А раствором вещества В с концентрацией 0,1 н для определения точки эквивалентности по резкому изменению рН получены следующие данные (табл. 14.3). Постройте кривую титрования в координатах рН = f(VB) и определите объем титранта В в точке эквивалентности. Запишите уравнение реакции и рассчитайте нормальную концентрацию раствора А.
345–348 По данным эксперимента, полученным фотоколометрическим методом (табл. 14.4), постройте график зависимости оптической плотности D раствора А от его концентрации и с его помощью определите неизвестную концентрацию раствора А, если измеренная оптическая плотность этого раствора равна Dх.
349–352 Постройте кривую кондуктометрического титрования 30 мл раствора А раствором титранта В с концентрацией 0,5 н в координатах = f(VB) по данным таблицы 14.5.
Определите объем титранта В в точке эквивалентности и рассчитайте нормальную концентрацию раствора А.
353–356 При полярографировании стандартных растворов свинца (II) получили следующие результаты:
|
|
0,50 |
1,00 |
1,50 |
2,00 |
|
h, мм |
4,0 |
8,0 |
12,0 |
16,0 |
Навеску алюминиевого сплава массой m (г) растворили и раствор разбавили до 50,00 мл. Высота полярографической волны свинца в полученном растворе оказалось равной hX. Вычислите массовую долю (%) свинца в анализируемом образце (см. табл. 14.6).
Таблица 14.6
|
Вариант |
353 |
354 |
355 |
356 |
|
m, г |
2,5000 |
5,134 |
5,300 |
4,518 |
|
h, мм |
6,0 |
9,0 |
11,0 |
8,0 |
357 Какую массу образца, содержащего 30 % серы, нужно взять для гравиметрического анализа, чтобы получить 0,300 г осадка BaSO4?
Ответ: 0,137г.
358 Какую массу вещества, содержащего 50 % железа, нужно взять для гравиметрического анализа, чтобы масса прокаленного осадка Fe2O3 была 0,100 г?
Ответ: 0,140 г.
359 Рассчитайте массу образца, содержащего 20 % Р2О5, необходимую для получения 0,300 г Mg2P2O7 в гравиметрическом анализе.
Ответ: 0,960 г.
360 Рассчитайте массу цемента, содержащего 30 % MgO, необходимого для получения 0,500 г осадка оксихинолината магния Mg(C9H6ON)2 в гравиметрическом анализе.
Ответ: 0,150 г.
Таблица 14.3
|
№ задачи |
Раствор вещества А |
Раствор вещества В |
Объем раствора вещества В, VB(мл) | |||||||
|
Объем раствора вещества В, VB(мл) | ||||||||||
|
341 |
H2SO4 |
NaOH |
VB, мл |
0 |
1 |
2 |
3 |
4 |
5 |
6 |
|
|
|
|
pH |
1,25 |
1,30 |
1,44 |
1,58 |
1,76 |
1,96 |
2,38 |
|
VB, мл |
7 |
8 |
9 |
10 |
11 |
12 |
| |||
|
pH |
3,15 |
8,82 |
10,62 |
11,23 |
11,52 |
11,73 |
| |||
|
342 |
КОН |
HCl |
VB,,мл) |
0 |
1 |
2 |
3 |
4 |
5 |
6 |
|
|
|
|
p |
11,94 |
11,92 |
11,87 |
11,53 |
11,12 |
10,04 |
3,18 |
|
VB, мл |
7 |
8 |
9 |
10 |
11 |
12 |
| |||
|
pH |
2,34 |
2,05 |
1,91 |
1,81 |
1,75 |
1,71 |
| |||
|
343 |
CH3COOH |
NaOH |
VB, мл |
0 |
1 |
2 |
3 |
4 |
5 |
6 |
|
|
|
|
pH |
2,97 |
3,41 |
3,98 |
4,18 |
4,45 |
4,69 |
5,12 |
|
VB, мл |
7 |
8 |
9 |
10 |
11 |
12 |
| |||
|
pH |
5,79 |
6,80 |
12,02 |
12,25 |
12,40 |
12,52 |
| |||
|
344 |
NaOH |
H2SO4 |
VB, мл |
0 |
1 |
2 |
3 |
4 |
5 |
6 |
|
|
|
|
pH |
11,85 |
11,77 |
11,63 |
11,32 |
10,71 |
8,91 |
3,14 |
|
VB, мл |
7 |
8 |
9 |
10 |
11 |
12 |
| |||
|
pH |
2,48 |
2,19 |
2,04 |
1,96 |
1,94 |
1,92 |
| |||

Таблица 14.4
|
№ |
А |
CA – концентрация А, моль/л |
Dx | ||||||
|
Оптическая плотность D | |||||||||
|
345 |
NiSO4 |
CA |
0,25 |
0,5 |
0,75 |
1,0 |
1,25 |
|
0,493 |
|
D |
0,127 |
0,273 |
0,402 |
0,531 |
0,669 |
| |||
|
346 |
Cu(NH3)4SO4 |
CA |
0,1 |
0,15 |
0,20 |
0,25 |
0,30 |
0,35 |
0,545 |
|
D |
0,209 |
0,315 |
0,420 |
0,510 |
0,614 |
0,691 | |||
|
3 |
((CH3)2C2N2OH)2Ni |
CA |
0,15 |
0,25 |
0,50 |
0,75 |
1,00 |
1,25 |
0,320 |
|
D |
0,075 |
0,112 |
0,207 |
0,291 |
0,382 |
0,479 | |||
|
348 |
Комплекс Fe (II) с алициловой кислотой |
CA∙10+5 |
1,09 |
1,98 |
3,03 |
3,94 |
5,12 |
|
0,610 |
|
D |
0,151 |
0,295 |
0,452 |
0,595 |
0,714 |
| |||

Таблица 14.5
|
№ |
A |
B |
Объем раствора вещества B, VB (мл) | ||||||||
|
Удельная электропроводность () | |||||||||||
|
3 |
BaCl2 |
Na2SO4 |
VB |
0,0 |
0,5 |
1,0 |
1,5 |
2,0 |
2,5 |
3,0 |
3,5 |
|
∙103 |
10,01 |
9,62 |
9,31 |
8,78 |
8,35 |
7,80 |
7,48 |
7,96 | |||
|
VB |
4,0 |
4,5 |
5,0 |
|
|
|
|
| |||
|
∙103 |
8,43 |
8,70 |
9,14 |
|
|
|
|
| |||
|
350 |
HCl |
NaOH |
VB |
0,0 |
1,0 |
2,0 |
3,0 |
4,0 |
5,0 |
6,0 |
7,0 |
|
∙103 |
4,95 |
4,02 |
2,89 |
1,72 |
2,05 |
3,01 |
3,90 |
7,43 | |||
|
VB |
8,0 |
|
|
|
|
|
|
| |||
|
∙103 |
5,78 |
|
|
|
|
|
|
| |||
|
351 |
CH3COOH |
NaOH |
VB |
0,0 |
1,0 |
2,0 |
3,0 |
4,0 |
5,0 |
6,0 |
7,0 |
|
∙103 |
1,61 |
1,70 |
1,81 |
1,92 |
2,02 |
2,12 |
2,23 |
3,03 | |||
|
VB |
8,0 |
9,0 |
10,0 |
|
|
|
|
| |||
|
∙103 |
4,52 |
5,89 |
7,23 |
|
|
|
|
| |||
|
352 |
n-нитроанилин |
HClO4 |
VB |
0,0 |
1,0 |
2,0 |
3,0 |
3,5 |
4,0 |
4,5 |
5,0 |
|
|
|
|
∙103 |
1,96 |
2,21 |
2,45 |
2,62 |
3,61 |
5,54 |
7,26 |
9,10 |

ТАБЛИЦА ВАРИАНТОВ
Студент выбирает себе контрольное задание по двум последним цифрам номера студенческого билета
|
Вариант |
Номер задач | ||||||
|
01 |
1 |
21 |
51 |
111 |
151 |
221 |
301 |
|
02 |
2 |
22 |
52 |
112 |
152 |
222 |
302 |
|
03 |
3 |
23 |
53 |
113 |
153 |
223 |
303 |
|
04 |
4 |
24 |
54 |
114 |
154 |
224 |
304 |
|
05 |
5 |
25 |
55 |
115 |
155 |
225 |
305 |
|
06 |
6 |
26 |
56 |
116 |
156 |
226 |
306 |
|
07 |
7 |
27 |
57 |
117 |
157 |
227 |
307 |
|
08 |
8 |
28 |
58 |
118 |
158 |
228 |
308 |
|
09 |
9 |
29 |
59 |
119 |
159 |
229 |
309 |
|
10 |
10 |
30 |
60 |
120 |
160 |
230 |
310 |
|
11 |
11 |
31 |
61 |
121 |
161 |
231 |
311 |
|
12 |
12 |
32 |
62 |
122 |
162 |
232 |
312 |
|
13 |
13 |
33 |
63 |
123 |
163 |
233 |
313 |
|
14 |
14 |
34 |
64 |
124 |
164 |
234 |
314 |
|
15 |
15 |
35 |
65 |
125 |
165 |
235 |
315 |
|
16 |
16 |
36 |
66 |
126 |
166 |
236 |
316 |
|
17 |
17 |
37 |
67 |
127 |
167 |
237 |
317 |
|
18 |
18 |
38 |
68 |
128 |
168 |
238 |
318 |
|
19 |
19 |
39 |
69 |
129 |
169 |
239 |
319 |
|
20 |
20 |
40 |
70 |
130 |
170 |
240 |
320 |
|
21 |
1 |
41 |
71 |
131 |
171 |
241 |
321 |
|
22 |
2 |
42 |
72 |
132 |
172 |
242 |
322 |
|
23 |
3 |
43 |
73 |
133 |
173 |
243 |
323 |
|
24 |
4 |
44 |
74 |
134 |
174 |
244 |
324 |
|
25 |
5 |
45 |
75 |
135 |
179 |
245 |
325 |
|
26 |
6 |
46 |
76 |
136 |
180 |
246 |
326 |
|
27 |
7 |
47 |
77 |
137 |
181 |
247 |
327 |
|
28 |
8 |
48 |
78 |
138 |
182 |
248 |
328 |
|
29 |
9 |
49 |
79 |
139 |
183 |
249 |
329 |
|
30 |
10 |
50 |
80 |
140 |
184 |
250 |
330 |
|
31 |
11 |
21 |
81 |
141 |
185 |
251 |
331 |
|
32 |
12 |
22 |
82 |
142 |
190 |
252 |
332 |
|
33 |
13 |
23 |
83 |
143 |
191 |
253 |
333 |
|
34 |
14 |
24 |
84 |
144 |
192 |
254 |
334 |
|
35 |
15 |
25 |
85 |
145 |
193 |
255 |
335 |
|
Продолжение таблицы вариантов | |||||||
|
36 |
16 |
26 |
86 |
146 |
194 |
256 |
336 |
|
37 |
17 |
27 |
87 |
147 |
195 |
257 |
337 |
|
38 |
18 |
28 |
88 |
148 |
196 |
258 |
338 |
|
39 |
19 |
29 |
89 |
149 |
197 |
259 |
339 |
|
40 |
20 |
30 |
90 |
150 |
198 |
260 |
340 |
|
41 |
1 |
31 |
91 |
111 |
199 |
261 |
341 |
|
42 |
2 |
32 |
92 |
112 |
200 |
262 |
342 |
|
43 |
3 |
33 |
93 |
113 |
201 |
263 |
343 |
|
44 |
4 |
34 |
94 |
114 |
202 |
264 |
344 |
|
45 |
5 |
35 |
95 |
115 |
203 |
265 |
345 |
|
46 |
6 |
36 |
96 |
116 |
204 |
266 |
346 |
|
47 |
7 |
37 |
97 |
117 |
205 |
267 |
347 |
|
48 |
8 |
38 |
98 |
118 |
206 |
268 |
348 |
|
49 |
9 |
39 |
99 |
119 |
207 |
269 |
349 |
|
50 |
10 |
40 |
100 |
120 |
209 |
270 |
350 |
|
51 |
11 |
41 |
101 |
121 |
210 |
271 |
351 |
|
52 |
12 |
42 |
102 |
122 |
211 |
272 |
352 |
|
53 |
13 |
43 |
103 |
123 |
212 |
273 |
353 |
|
54 |
14 |
44 |
104 |
124 |
213 |
274 |
354 |
|
55 |
15 |
45 |
105 |
125 |
214 |
275 |
355 |
|
56 |
16 |
46 |
106 |
126 |
215 |
276 |
356 |
|
57 |
17 |
47 |
107 |
127 |
216 |
277 |
357 |
|
58 |
18 |
48 |
108 |
128 |
217 |
278 |
358 |
|
59 |
19 |
49 |
109 |
129 |
218 |
279 |
359 |
|
60 |
20 |
50 |
110 |
130 |
219 |
280 |
360 |
|
61 |
1 |
21 |
51 |
131 |
220 |
281 |
301 |
|
62 |
2 |
22 |
52 |
132 |
151 |
282 |
302 |
|
63 |
3 |
23 |
53 |
133 |
152 |
283 |
303 |
|
64 |
4 |
24 |
54 |
134 |
153 |
284 |
304 |
|
65 |
5 |
25 |
55 |
135 |
154 |
285 |
305 |
|
66 |
6 |
26 |
56 |
136 |
155 |
286 |
306 |
|
67 |
7 |
27 |
57 |
137 |
156 |
287 |
307 |
|
68 |
8 |
28 |
58 |
138 |
157 |
288 |
308 |
|
69 |
9 |
29 |
59 |
139 |
158 |
289 |
309 |
|
70 |
10 |
30 |
60 |
140 |
159 |
290 |
310 |
|
71 |
11 |
31 |
61 |
141 |
160 |
291 |
311 |
|
72 |
12 |
32 |
62 |
142 |
161 |
292 |
312 |
|
73 |
13 |
33 |
63 |
143 |
162 |
293 |
313 |
|
74 |
14 |
34 |
64 |
144 |
163 |
294 |
314 |
|
75 |
15 |
35 |
65 |
145 |
164 |
295 |
315 |
|
76 |
16 |
36 |
66 |
146 |
165 |
296 |
316 |
|
77 |
17 |
37 |
67 |
147 |
166 |
297 |
317 |
|
Окончание таблицы вариантов | |||||||
|
78 |
18 |
38 |
68 |
148 |
167 |
298 |
318 |
|
79 |
19 |
39 |
69 |
149 |
168 |
299 |
319 |
|
80 |
20 |
40 |
70 |
150 |
169 |
300 |
320 |
|
81 |
1 |
41 |
71 |
111 |
170 |
221 |
321 |
|
82 |
2 |
42 |
72 |
112 |
171 |
222 |
322 |
|
83 |
3 |
43 |
73 |
113 |
172 |
223 |
323 |
|
84 |
4 |
44 |
74 |
114 |
173 |
224 |
324 |
|
85 |
5 |
45 |
75 |
115 |
174 |
225 |
325 |
|
86 |
6 |
46 |
76 |
116 |
179 |
226 |
326 |
|
87 |
7 |
47 |
77 |
117 |
180 |
251 |
327 |
|
88 |
8 |
48 |
78 |
118 |
181 |
252 |
328 |
|
89 |
9 |
49 |
79 |
119 |
182 |
253 |
329 |
|
90 |
10 |
50 |
80 |
120 |
183 |
254 |
330 |
|
91 |
11 |
21 |
81 |
121 |
184 |
255 |
341 |
|
92 |
12 |
22 |
82 |
122 |
185 |
256 |
342 |
|
93 |
13 |
23 |
83 |
123 |
190 |
257 |
343 |
|
94 |
14 |
24 |
84 |
124 |
191 |
258 |
344 |
|
95 |
15 |
25 |
85 |
125 |
192 |
259 |
345 |
|
96 |
16 |
26 |
86 |
126 |
193 |
260 |
346 |
|
97 |
17 |
27 |
87 |
127 |
194 |
261 |
347 |
|
98 |
18 |
28 |
88 |
128 |
195 |
262 |
348 |
|
99 |
19 |
29 |
89 |
129 |
196 |
263 |
349 |
|
00 |
20 |
30 |
90 |
130 |
197 |
264 |
350 |


 e2+
e2+



 3[Fe(CN)6]
(красная кровяная соль)
3[Fe(CN)6]
(красная кровяная соль)
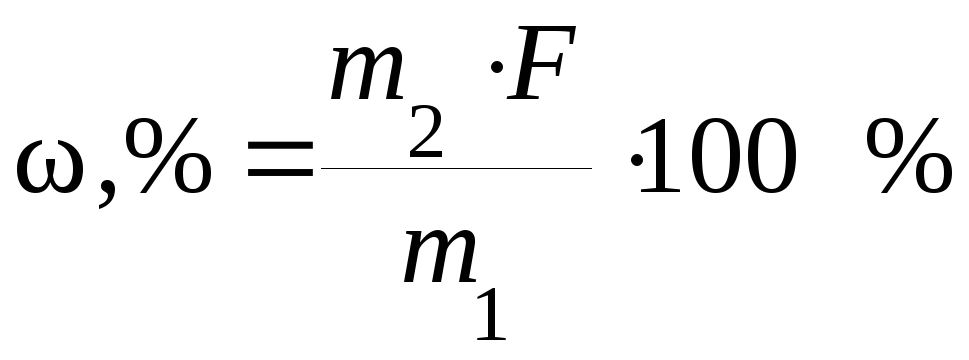 ,
,
 H
H 47
47 49
49