
- •Росжелдор
- •Введение: основные понятия и определения
- •Основы номенклатуры неорганических соединений можно изложить следующим образом:
- •1 Классы неорганических соединений
- •Растворимость солей, кислот и оснований в воде
- •2 Химическая термодинамика
- •3 Скорость химических реакций
- •3.1 Количественное определение скорости химической реакции
- •3.2 Влияние катализатора
- •4 Химическое равновесие
- •4.1 Понятие о химическом равновесии
- •4.2 Динамический характер и устойчивость химического равновесия
- •4.3 Константа химического равновесия
- •4.4 Положение равновесия и его зависимость от внешних факторов
- •4.4.1 Зависимость равновесия от концентрации
- •4.4.2 Зависимость равновесия от температуры
- •4.4.3 Влияние давления на равновесие
- •4.4.4 Влияние катализатора на равновесие
- •В выражение константы равновесия входят равновесные концентрации веществ:
- •5 Строение электронных оболочек атомов. Периодический закон д.И. Менделеева
- •6 Химическая связь и строение молекул
- •7 Растворы
- •7.1 Способы выражения концентрации растворов
- •7.2 Физико-химические свойства разбавленных растворов неэлектролитов. Давление пара растворов. Закон Рауля
- •7.2.1 Понижение температуры замерзания и повышение температуры кипения растворов (следствия из закона Рауля)
- •7.3 Растворы электролитов
- •7.4 Ионное произведение воды. Водородный показатель рН
- •8 Окислительно-восстановительные реакции
- •9 Гальванические элементы
- •9.1 Понятие об электродном потенциале
- •9.2 Гальванический элемент
- •10 Коррозия металлов
- •10.1 Защита от коррозии
- •11 Электролиз
- •11.1 Катодные процессы
- •11.2 Анодные процессы
- •12 Полимеры
- •12.1 Реакция полимеризации
- •12.2 Реакция поликонденсации
- •12.3 Полимерные материалы
- •13 Дисперсные системы
- •14 Химический анализ
- •Библиографический список
- •Содержание
- •Мигаль Юрий Фёдорович
11 Электролиз
Электролиз – совокупность окислительно-восстановительных процессов, происходящих на электродах при прохождении постоянного электрического тока через раствор или расплав электролита.
Анод (А) – это электрод, на котором происходит процесс окисления. Катод (К) – электрод, на котором происходит процесс восстановления. При электролизе катод подключается к отрицательному полюсу источника тока, а анод – к положительному.
Рассмотрим сущность процесса на примере электролиза расплава NaОН с угольными электродами. В расплавах, как и в растворах, молекулы электролитов диссоциируют на ионы:
NaОН Na+ + ОН–.
Прохождение электрического тока вызывает направленное перемещение ионов. Катионы натрия Na+ движутся к катоду и принимают от него электроны:
![]()
Анионы ОН– подходят к аноду и отдают электроны:
![]()
Суммарная реакция электролиза расплава вещества NaОН представлена суммой двух электродных процессов и выражается уравнением:
![]()
Электролиз расплавов солей или оксидов используют в технике для получения активных металлов (Li, Na, K, Ca, Al).
В водных растворах, кроме ионов самого электролита, находятся молекулы воды, которые также могут участвовать в процессах окисления и восстановления на электродах.
Для определения результатов электролиза растворов можно пользоваться следующими правилами.
11.1 Катодные процессы
На катоде легче восстанавливаются катионы с бóльшим стандартным электродным потенциалом φ0.
Так,
если стандартный электродный потенциал
металла больше величины –0,41 В, то на
катоде обычно восстанавливаются
ионы этого металла. Если потенциал
металла находится в интервале
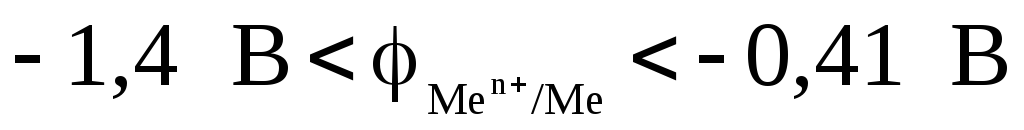 ,
то на катоде одновременно восстанавливаются
и ионы металла, и вода. Если потенциал
металла меньше величины –1,4 В, то на
катоде восстанавливается только вода.
Отмеченное выше можно представить в
виде следующей схемы:
,
то на катоде одновременно восстанавливаются
и ионы металла, и вода. Если потенциал
металла меньше величины –1,4 В, то на
катоде восстанавливается только вода.
Отмеченное выше можно представить в
виде следующей схемы:
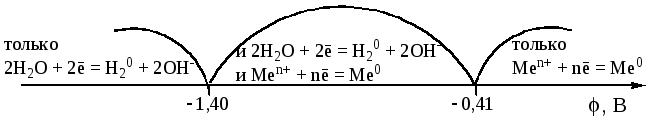
11.2 Анодные процессы
Аноды, используемые при электролизе, подразделяются на инертные (графит, уголь, платина, золото, иридий) и активные (остальные металлы).
На аноде в первую очередь окисляется система с меньшим окислительно-восстановительным потенциалом. Но в ряде случаев из-за сложности разряда кислородосодержащих ионов (NO–3,SO2–4,PO3–4,CO2–3и т. д.) это правило не выполняется. Вид анодной реакции в общем случае определяется природой разряжающей частицы.
В случае использования активного(растворимого) анода окисляется металл анода:
Ме0–nē = Меn+.
При электролизе с инертныманодом легко окисляются простые анионы бескислородных кислот, присутствующие в растворе (I–,Br–,Cl–).
Сложные ионы
кислородсодержащих кислот (SO![]() ,CO
,CO![]() ,PO
,PO![]() и др.) в водных растворах, как правило,
не окисляются – вместо них окисляется
вода:
и др.) в водных растворах, как правило,
не окисляются – вместо них окисляется
вода:
2Н2О – 4ē = О2+ 4Н+.
Последовательность процессов окисления на аноде можно представить следующей схемой:

Пример 1.Составить уравнения катодного и анодного процессов, протекающих при электролизе водного раствораK2SO4на угольных электродах.
Решение
В водном растворе соль K2SO4диссоциирует:K2SO4 2К++SO2–4 .
К катоду подходят
катионы К+и молекулы Н2О,
к аноду – ионыSO2–4и молекулы Н2О. Поскольку потенциал
системы![]() (см. табл. 9.1) меньше, чем –1,4 В, на катоде
будут восстанавливаться молекулы воды
(см. вышеприведенную схему).
(см. табл. 9.1) меньше, чем –1,4 В, на катоде
будут восстанавливаться молекулы воды
(см. вышеприведенную схему).
Анионы SO2–4– это сложные ионы, в водных растворах они не окисляются. Поэтому на аноде окисляются молекулы воды.
![]()
![]()
Раствор у катода подщелачивается (появляются ионы ОН–), у анода становится более кислым (появляются ионы Н+). Суммарное молекулярное уравнение реакции электролиза:
![]()
КОН и Н2SO4 образуются из К+ и ОН–, Н+ и SO2–4, находящихся в растворе.
Пример 2.Составить уравнения катодного и анодного процессов, протекающих при электролизе раствораCuCl2с медным анодном.
Решение
В водном растворе соль CuCl2диссоциирует:CuCl2 Сu2++ 2Cl–.
К катоду подходят катионы Сu2+и Н2О; к аноду – ионыCl–и Н2О. Медный анод – растворимый, он принимает участие в электродной реакции. Потенциал φ0Сu/Cu2+= 0,34 В, и на катоде, в соответствии с вышеприведенной схемой, будет восстанавливаться Сu2+. В анодном процессе участвует металл анода (Cu-растворимый анод):
![]()
![]()
В результате электролиза медь переносится с анода на катод, а соль оказывается не затронутой этим процессом и обеспечивает лишь электропроводность.
Количественная характеристика процессов электролиза даётся законамиФарадея. Им можно дать следующую общую формулировку:
масса электролита, подвергшаяся превращению при электролизе, а также массы образующихся на электродах веществ прямо пропорциональны количеству электричества, прошедшего через раствор или расплав электролита, и эквивалентным массам соответствующих веществ.
Объединенный закон Фарадея выражается следующим уравнением:
![]() ,
,
где А– атомная масса вещества простого вещества, выделяющегося на электроде;
n– заряд иона или число электронов, принимающих участие в процессе электролиза;
I– сила тока в амперах, А;
t– время пропускания тока в секундах, с;
F– число Фарадея (F= 96 500 Кл/моль).
Эквивалентная масса вещества
![]() .
.
Поскольку обычно имеются конкурирующие процессы, законы Фарадея нуждаются в поправках.
Отношение массы фактически выделившегося на электроде вещества mпр. к массе вещества, которая должна была выделиться в соответствии с законом Фарадея, называется выходом по току:
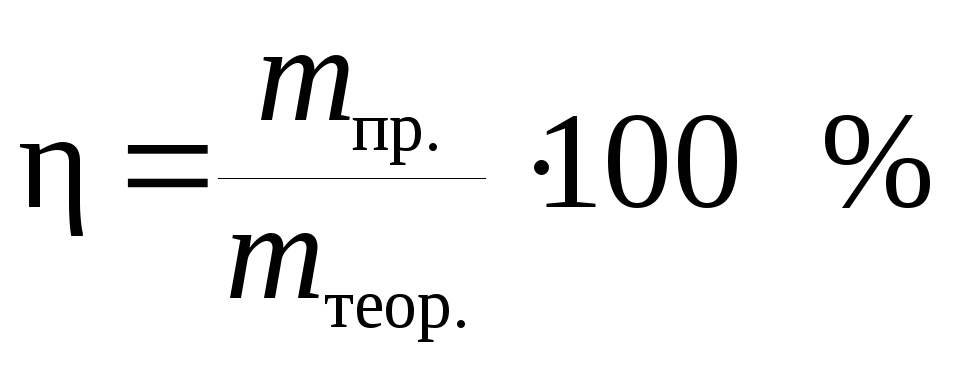 .
.
Пример 3. При прохождении электрического тока силой 1 А через растворFeCl2 (электроды инертные) в течение 1 ч выделилось 0,90 г железа. Определите выход по току. На какие процессы расходуется остальной ток?
Решение
Так как атомная масса Feравна 56 г/моль, то в соответствии с законом Фарадея теоретическое значение массы железа, выделяющегося на катоде, составляет:
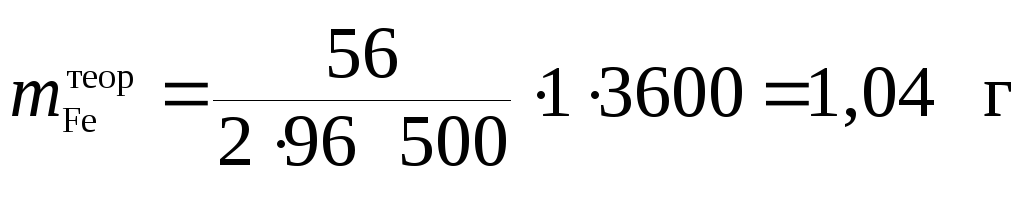 .
.
Выход по току:
 .
.
Обратимся к
схеме процессов на катоде. Поскольку
величина ![]() лежит в области –1,4 В < φ < –0,41 В, то
на катоде идет совместное восстановление
ионов железаFe2+ и
молекул воды. Преимущественно
восстанавливаются ионыFe2+:
лежит в области –1,4 В < φ < –0,41 В, то
на катоде идет совместное восстановление
ионов железаFe2+ и
молекул воды. Преимущественно
восстанавливаются ионыFe2+:
Fe2+ + 2ē =Fe
и, частично, молекулы воды:
2Н2O + 2ē = Н2↑ + 2OH–.
Таким образом, часть тока, протекающая через электролит, затрачивается на восстановление воды.
Пример 4.Электрический ток силой 1 А проходит в течение 1 часа через растворZnCl2(электроды инертные). Определить количество выделившегося на катоде за указанное время цинка, если выход по току равен 64%. Объяснить, на какие процессы расходуется остальной ток.
Решение
Потенциал
![]() В
(см. табл. 9.1) и лежит в области
–1,4 В
<<0,41
В. Следовательно, на катоде будет идти
совместное восстановление катионовZn2+и, частично,
молекул воды:
В
(см. табл. 9.1) и лежит в области
–1,4 В
<<0,41
В. Следовательно, на катоде будет идти
совместное восстановление катионовZn2+и, частично,
молекул воды:
Zn2++ 2ē =Zn
2H2O+ 2ē = 2OH+H2(частично, побочный процесс)
Для определения теоретического количества выделившегося на катоде цинка воспользуемся уравнением закона Фарадея:
![]() г.
г.
Выход по току вычисляется по формуле
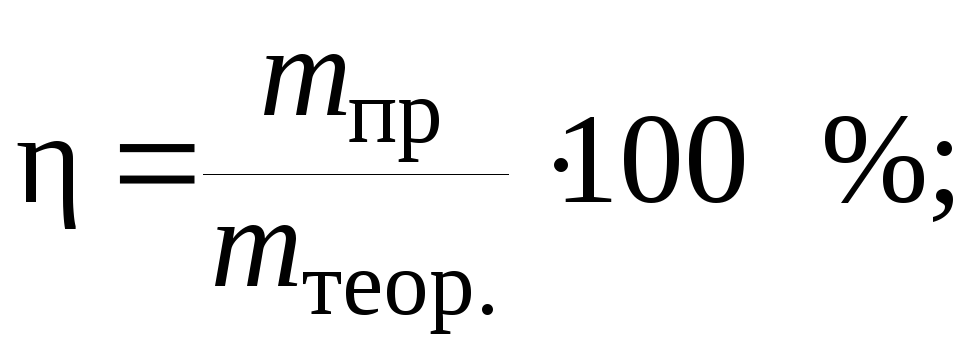
следовательно
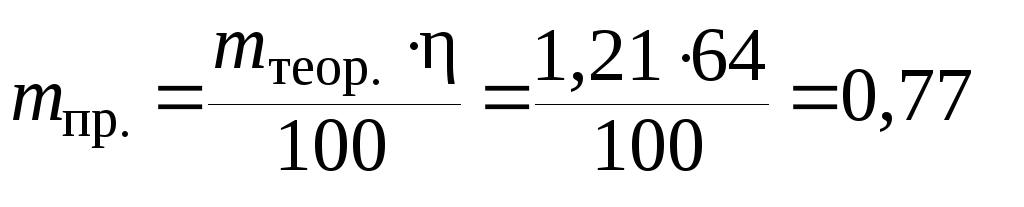 г.
г.
На получение цинка на катоде расходуется 64 % всего прошедшего через электролит тока, остальной ток тратится на восстановление воды.
Задачи
271–277Составьте электронные уравнения процессов, протекающих на катоде и аноде при электролизе:
1) расплава вещества А с графитовыми электродами;
2) раствора вещества Б с графитовыми электродами;
3) раствора вещества В с растворимым (активным) анодом.
Масса твердого вещества, выделившегося на катоде при электролизе раствора вещества Б при прохождении тока I(А) в течение времени τ (ч), составляетm (г). Вычислите выход по току. Объясните, почему в ряде случаев не весь ток расходуется на выделение металла.
|
№ задачи |
Соединения |
Растворимый анод |
I, А |
τ, час |
m, г | ||
|
А |
Б |
В | |||||
|
271 |
KCl |
SnCl2 |
ZnSO4 |
Zn |
8,5 |
2 |
36,6 |
|
272 |
FeCl2 |
ZnSO4 |
MgCl2 |
Mg |
10 |
1,5 |
11,3 |
|
273 |
NaOH |
FeCl2 |
MnSO4 |
Mn |
12 |
0,5 |
4,2 |
|
274 |
PbCl2 |
Cu(NO3)2 |
FeCl2 |
Fe |
6 |
1 |
7,1 |
|
275 |
Ca(OH)2 |
NiCl2 |
AlCl3 |
Al |
9,3 |
2 |
18,8 |
|
276 |
LiBr |
MnSO4 |
CoCl2 |
Co |
10,5 |
0,5 |
3,0 |
|
277 |
SnCl2 |
FeSO4 |
Pb(NO3)2 |
Pb |
8,8 |
2 |
14,2 |
Ответ: 271) 97 %; 272) 62 %; 273) 67 %; 274) 99 %; 275) 91,9 %; 276) 55,8 %; 277) 77,3 %.
278–284.Составьте электронные уравнения процессов, протекающих на катоде и аноде при электролизе:
1) расплава вещества А с графитовыми электродами;
2) раствора вещества Б с графитовыми электродами;
3) раствора вещества В с растворимым (активным) анодом.
Вычислите время, необходимое для практического получения 100 г металла из раствора вещества Б при силе тока I, если выход по току.
|
№ задачи |
Вещества |
Растворимый анод |
I, A |
, % | ||
|
А |
Б |
В | ||||
|
278 |
SnCl2 |
Fe(NO3)2 |
NiSO4 |
Ni |
12 |
66,7 |
|
279 |
Ni(OH)2 |
CoCl2 |
Pb(NO3)2 |
Pb |
9,5 |
96 |
|
280 |
MgCl2 |
ZnSO4 |
NiSO4 |
Zn |
6,4 |
82 |
|
281 |
ZnCl2 |
AgNO3 |
CuCl2 |
Cu |
14,8 |
99 |
|
282 |
CuBr2 |
Cd(NO3)2 |
AgNO3 |
Ag |
8,7 |
86 |
|
283 |
NaOH |
Pb(NO3)2 |
NiCl2 |
Ni |
5,9 |
94 |
|
284 |
PbCl2 |
CоSO4 |
Mg(NO3)2 |
Mg |
10 |
74 |
Ответ: 278) 12 ч; 279) 10 ч; 280) 17,3 ч; 281) 1,7 ч; 282) 6,4 ч; 283) 4,7 ч; 284) 12,3 ч.
285–291Составьте электронные уравнения процессов, протекающих на катоде и аноде при электролизе:
1) расплава вещества А с графитовыми электродами;
2) раствора вещества Б с графитовыми электродами;
3) раствора вещества В с растворимым (активным) анодом.
Как изменится масса анода после пропускания тока силой I(А) в течение времени τ (ч) через раствор В?
|
№ задачи |
Вещества |
Растворимый анод |
I, A |
τ, час | ||
|
А |
Б |
В | ||||
|
285 |
NaI |
MgSO4 |
ZnCl2 |
Zn |
8,5 |
2 |
|
286 |
CaCl2 |
Cu(NO3)2 |
FeCl2 |
Fe |
10 |
3 |
|
287 |
RbCl |
AgNO3 |
CuSO4 |
Cu |
7,5 |
2,5 |
|
288 |
KOH |
ZnCl2 |
CoCl2 |
Co |
3,7 |
1 |
|
289 |
CuCl2 |
NaNO3 |
Pb(NO3)2 |
Pb |
2,5 |
4 |
|
290 |
NaOH |
Bi(NO3)3 |
NiCl2 |
Ni |
2,0 |
2,5 |
|
291 |
CaI2 |
H2SO4 |
Cd(NO3)2 |
Cd |
6,8 |
0,8 |
Ответ: 285) 20,6 г; 286) 31,3 г; 287) 22,4 г; 288) 4,1 г; 289) 38,6 г; 290) 5,5 г; 291) 7,1 г.
292–300Составьте электронные уравнения процессов, протекающих на катоде и аноде при электролизе:
1) расплава вещества А с графитовыми электродами;
2) раствора вещества Б с графитовыми электродами;
3) раствора вещества В с растворимым (активным) анодом.
Постройте график зависимости изменения массы растворимого анода mот силы токаIпри времени электролиза 0,5 ч. Сила токаIравна 0,5; 1; 2; 3 и 5 А.
|
№ задачи |
Соединения |
Растворимый анод | ||
|
А |
Б |
В | ||
|
292 |
KOH |
Na2SO4 |
NiCl2 |
Ni |
|
293 |
RbCl |
Li2SO4 |
Pb(NO3)2 |
Pb |
|
294 |
NaCl |
Ni(NO3)2 |
AgNO3 |
Ag |
|
295 |
AlCl3 |
Fe2(SO4)3 |
CuSO4 |
Cu |
|
296 |
NaI |
Cu(NO3)2 |
ZnCl2 |
Zn |
|
297 |
SnCl2 |
CoSO4 |
CuSO4 |
Cu |
|
298 |
CoCl2 |
BiСl3 |
AgNO3 |
Ag |
|
№ задачи |
Соединения |
Растворимый анод | ||
|
А |
Б |
В | ||
|
299 |
KCl |
SnCl2 |
ZnSO4 |
Zn |
|
300 |
NaI |
Cu(NO3)2 |
PbCl2 |
310 |
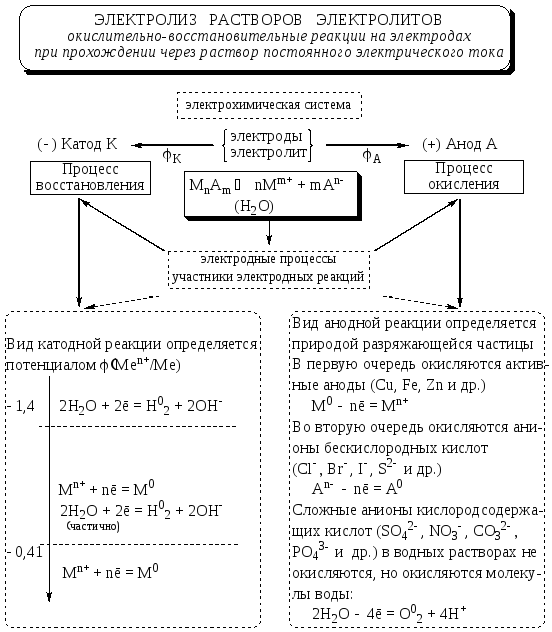
Рис. 11.1. Структурно-логическая схема взаимосвязи электродных процессов при электролизе
