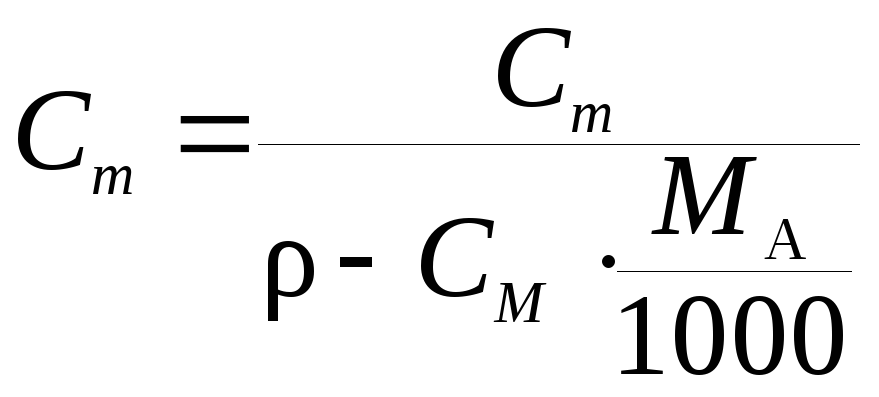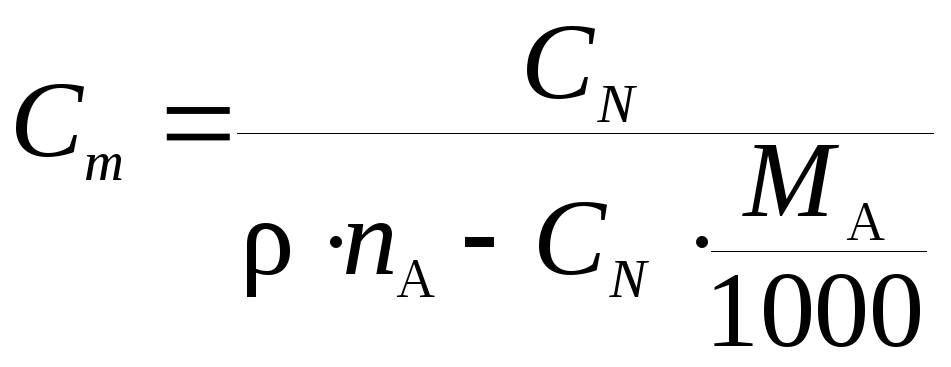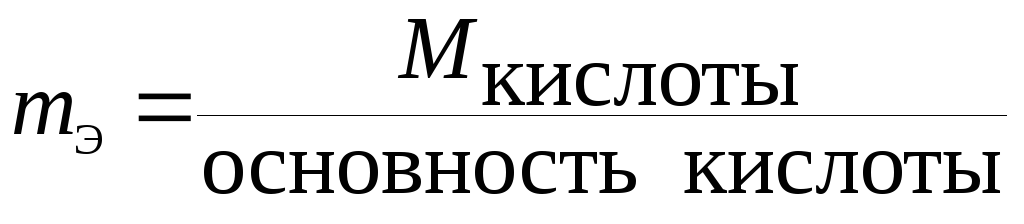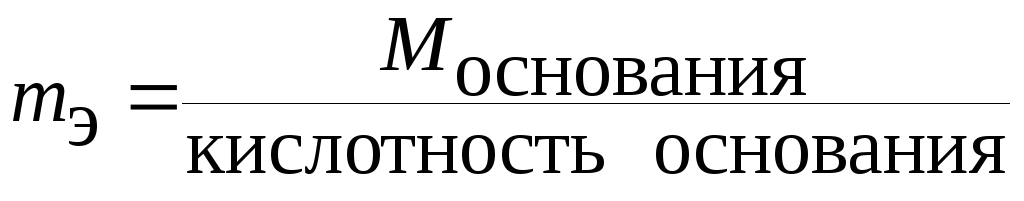- •Росжелдор
- •Введение: основные понятия и определения
- •Основы номенклатуры неорганических соединений можно изложить следующим образом:
- •1 Классы неорганических соединений
- •Растворимость солей, кислот и оснований в воде
- •2 Химическая термодинамика
- •3 Скорость химических реакций
- •3.1 Количественное определение скорости химической реакции
- •3.2 Влияние катализатора
- •4 Химическое равновесие
- •4.1 Понятие о химическом равновесии
- •4.2 Динамический характер и устойчивость химического равновесия
- •4.3 Константа химического равновесия
- •4.4 Положение равновесия и его зависимость от внешних факторов
- •4.4.1 Зависимость равновесия от концентрации
- •4.4.2 Зависимость равновесия от температуры
- •4.4.3 Влияние давления на равновесие
- •4.4.4 Влияние катализатора на равновесие
- •В выражение константы равновесия входят равновесные концентрации веществ:
- •5 Строение электронных оболочек атомов. Периодический закон д.И. Менделеева
- •6 Химическая связь и строение молекул
- •7 Растворы
- •7.1 Способы выражения концентрации растворов
- •7.2 Физико-химические свойства разбавленных растворов неэлектролитов. Давление пара растворов. Закон Рауля
- •7.2.1 Понижение температуры замерзания и повышение температуры кипения растворов (следствия из закона Рауля)
- •7.3 Растворы электролитов
- •7.4 Ионное произведение воды. Водородный показатель рН
- •8 Окислительно-восстановительные реакции
- •9 Гальванические элементы
- •9.1 Понятие об электродном потенциале
- •9.2 Гальванический элемент
- •10 Коррозия металлов
- •10.1 Защита от коррозии
- •11 Электролиз
- •11.1 Катодные процессы
- •11.2 Анодные процессы
- •12 Полимеры
- •12.1 Реакция полимеризации
- •12.2 Реакция поликонденсации
- •12.3 Полимерные материалы
- •13 Дисперсные системы
- •14 Химический анализ
- •Библиографический список
- •Содержание
- •Мигаль Юрий Фёдорович
7 Растворы
7.1 Способы выражения концентрации растворов
Раствором называется гомогенная система переменного состава, образованная двумя или несколькими веществами (компонентами).
В инженерной практике широко применяют жидкие растворы (в дальнейшем «растворы»), состоящие из жидкого растворителя (чаще всего воды) и одного или нескольких растворенных веществ, которые до растворения (смешивания) могли быть твердыми, жидкими или газообразными.
Важнейшая характеристика раствора – концентрация, выражающая относительное содержание веществ в растворе.
Наиболее употребительные способы выражения концентрации вещества в растворе приведены в таблице 7.1.
Различные способы выражения концентрации связаны между собой, что позволяет в каждом конкретном случае осуществить переход от одного способа к другому (табл. 7.2).
Так как вещества взаимодействуют в эквивалентных количествах (закон эквивалентов), то растворы одинаковой нормальности реагируют в равных объемах. В общем случае, объемы растворов V1 и V2 прореагировавших веществ обратно пропорциональны их нормальностям (CN1, CN2):
|
|
|
(7.1) |
При взаимодействии раствора объемом V, выраженному в мл, и нормальностью СN c твердым веществом массой mА и эквивалентной массой mЭ закон эквивалентов выражается соответствием:
|
|
|
(7.2) |
Рассмотрим решение типичных задач.
Пример 1. Азотную кислоту массой 10 г растворили в 40 мл воды. Плотность полученного раствора 1,115 г/мл. Вычислите массовую долю HNO3 в полученном растворе (HNO3), молярную CM, нормальную CN и моляльную Cm концентрации азотной кислоты в растворе.
Решение
1 Для определения массовой доли найдем массу раствора mр (плотность воды равна 1 г/мл), масса воды равна 40 г или 0,04 кг):
mр = mв + m(H2O) = 10 + 40 = 50 г,
и вычислим массовую долю HNO3 в полученном растворе:
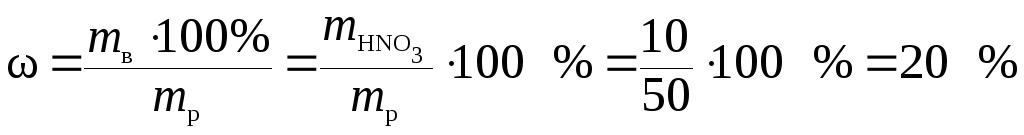 .
.
2 Для определения молярной концентрации найдем количество HNO3, содержащееся в 1 л раствора.
Для этого найдем массу 1 л (1000 мл) раствора:
mр = V ∙ ρ = 1000 ∙ 1,115 = 1115 г,
определим массу азотной кислоты в этом растворе:
m(HNO3) = mр ∙ ω = 1115 ∙0,2 = 223 г
и вычислим молярную концентрацию HNO3 в растворе:
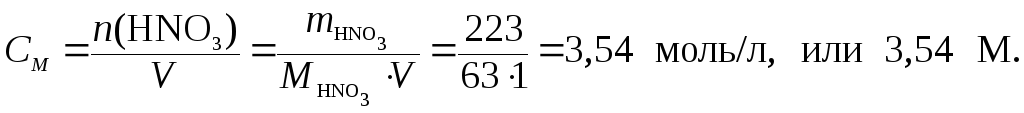
3 Для определения нормальной концентрации найдем количество моль-эквивалентов HNO3, содержащееся в 1 л раствора.
Для этого найдем эквивалентную массу HNO3:
mэ(HNO3) = M(HNO3)/1 = 63 г/моль-экв
и вычислим нормальную концентрацию HNO3
![]() моль-экв/л,
или 3,53 н.
моль-экв/л,
или 3,53 н.
4 Рассчитаем моляльную концентрацию:

Эту задачу можно решить и с использованием формул для пересчета концентрации растворов, приведенных в табл. 7.2.
Молярную концентрацию HNO3 в растворе найдем исходя из массовой доли (см. табл. 7.2).
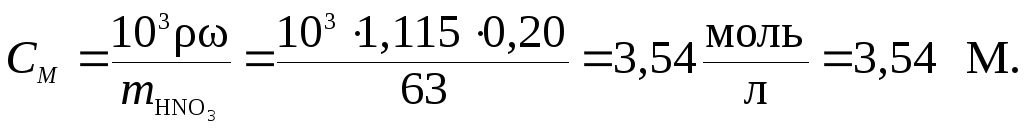
Так как молярная масса HNO3 равна эквивалентной массе (HNO3 – одноосновная кислота, см. табл. 7.2), то нормальная (эквивалентная) концентрация равна молярной концентрации
СN = СM = 3,54 моль-экв/л, или 3,54 н.
Таблица 7.1
Способы выражения концентрации растворов
|
Название и обозначение |
Определение |
Расчетная формула |
Пример |
Размерность |
|
Массовая доля ω |
Отношение массы растворенного вещества mв к массе раствора m |
a)
б)
|
20 % раствор соли в воде: 20 г соли (вещества) содержится в 100 г раствора |
а) нет
б) масс. % |
|
М |
Отношение количества растворенного вещества nA к общему количеству всех веществ в растворе |
|
|
нет |
|
Молярная концентрация (молярность) СM |
Отношение количества растворенного вещества nA к объему раствора V |
|
1 М K2SO4: раствор K2SO4, содержащий 1 моль К2SO4 в 1 л раствора |
моль/л |
|
Нормальная концентрация (нормальность) СN |
Отношение количества моль-эквивалентов nЭ вещества к объему раствора V |
|
СN(Н2SO4) = 1 н: раствор H2SO4, содержащий 1 моль-экв H2SO4 в 1 л раствора |
моль-экв/л |
|
Моляльная концентрация (моляльность) Сm |
Отношение количества растворенного вещества nA к массе растворителя mВ |
|
Cm = 1 моль/кг K2SO4: раствор K2SO4, содержащий 1 моль вещества (K2SO4) в 1 кг воды (растворителя) |
моль/кг |

Таблица 7.2
Формулы для пересчета концентраций растворов
|
Способ выражения концентрации |
ω |
СM, моль/л |
СN, моль-экв/л |
Сm, моль/кг |
|
Массовая доля, ω |
|
|
|
|
|
М |
|
|
|
|
|
Нормальная (эквивалентная) концентрация СN |
|
|
|
|
|
Моляльная концентрация Сm |
|
|
|
|
|
В
таблице использованы обозначения:
МA
– молярная масса растворенного
вещества (г), mЭ
–
эквивалентная
масса растворенного вещества (г); n
– число эквивалентных масс, содержащихся
в молярной массе растворенного
вещества ( | ||||

Моляльную концентрацию раствора HNO3 можно найти по одной из формул пересчета концентраций исходя, например, из массовой доли (нижняя строка табл. 7.2)
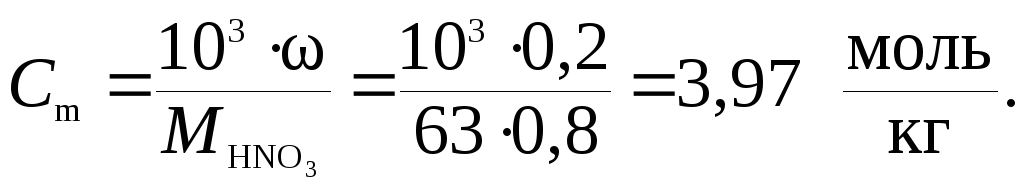
Примеры расчета эквивалентных масс кислот, оснований и солей приведены в табл. 7.3.
Таблица 7.3
Примеры расчета эквивалентных масс кислот, оснований, солей
|
Класс вещества и формула для определения эквивалентной массы mЭ |
Пример |
|
Кислота
|
|
|
Основание
|
|
|
Соль
|
|
На практике часто приходится готовить разбавленный раствор с массовой долей растворенного вещества ωА′ и массой m′ из концентрированного раствора этого же вещества (ωА, m), разбавляя последний водой массой m(H2O). Ясно, что масса растворенного вещества и в концентрированном, и в разбавленном растворе постоянна, увеличивается лишь масса вновь приготовленного раствора:
m′ = m + m(H2O).
Все величины связаны между собой соответствием:
|
|
ωА′m′ = ωА′ [m + m(H2O)] = ωА∙m. |
(7.3) |
Необходимость приготовления раствора промежуточого состава (ω′′, m′′) появляется при смешивании концентрированного раствора (ωА, m) и разбавленного (ωА′, m′) растворов. Масса растворенного вещества в приготовленном растворе равна сумме масс этого вещества в концентрированном и разбавленном растворах. Для этого случая все величины связаны соотношением:
|
|
ωА′′ ∙ m′′ = ωА′′(m′ + m) = ωА′m′ + ωАm. |
(7.4) |
При выполнении расчетов, связанных с концентрацией растворов, полезными могут быть формулы для определения массы растворенного вещества (mА) или числа молей растворенного вещества(υА):
|
|
mA = ω∙m, |
(7.5) |
|
|
mA = ω∙ρ∙V, |
(7.6) |
где m – масса (г), V – объем (мл или см3, л) и – плотность (г/мл, г/см3, кг/л) раствора с массовой долей ω растворенного вещества.
Пример 2. Вычислить объем V (л) разбавленного раствора с массовой долей Н2SO4 1,0 % и плотностью 1,006 г/мл, приготовленного добавлением воды к 250 мл концентрированного раствора с массовой долей Н2SO4 6,0 % и плотностью 1,041 г/мл. Рассчитать массовую долю растворенного вещества в разбавленном растворе.
Решение
При разбавлении концентрированного раствора растворителем (водой) увеличивается масса раствора, но масса растворенного вещества (Н2SO4) остается постоянной и во вновь приготовленном растворе. Следовательно, изменяется отношение масс растворенного вещества и раствора, то есть концентрация.
С учетом равенства массы Н2SO4 в концентрированном и разбавленном растворах используем формулу (7.3):
ω′m′ = ω′ (m + m(H2O)) = ω∙m,
где ω, m – массовая доля, масса концентрированного раствора;
ω′, m′ – массовая доля, масса разбавленного раствора.
Массу раствора можно выразить через объем раствора и его плотность:
m = V∙ρ.
С учетом этого соотношения преобразуем формулу (7.6):
ω′V′ρ′ = ωVρ.
Отсюда
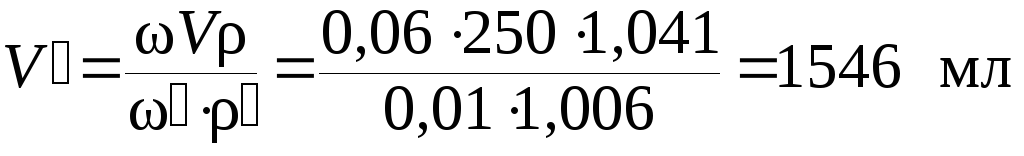 .
.
Для нахождения молярной доли Н2SO4 необходимо вычислить массу (m′) Н2SO4 и массу Н2О в разбавленном 1,0 %-ном растворе
m′ = ω′∙mр-ра = ω′∙V′∙ρ′ = 0,01∙154∙1,006 = 15,553 г;
mр-ра = V′∙ρ′ = 1546∙1,006 = 1555,276 г;
m(H2O) = mр-ра – m′ = 1555,276 – 15,553 = 1539,723 г;
M(H2SO4) = 2∙1 + 32 + 4∙16 = 98 г/моль; М(Н2О) = 2∙1 + 16 = 18 г/моль.
Определим молярную долю Н2SO4 в растворе (см. табл. 7.1).

Пример 3. Рассчитать массовую долю (ω′′) серной кислоты в растворе, приготовленном смешением 50 мл разбавленного раствора с молярной концентрацией 1,1 моль/л и плотностью 1,06 г/мл с 10 мл концентрированного раствора с массовой долей Н2SO4 98 % и плотностью 1,9 г/мл.
Решение
Вычисляем массовую долю (ω′) Н2SO4 в разбавленном растворе, воспользовавшись формулой для пересчета молярной концентрации (СМ) в массовую долю из табл. 7.2. Молярная масса серной кислоты М(H2SO4) = 98 г/моль.
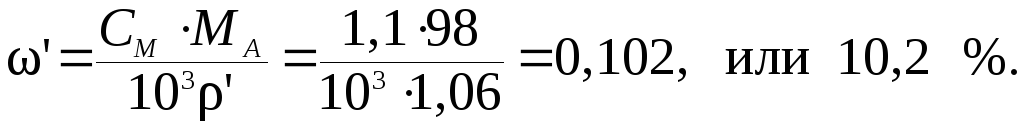
Для расчета массовой доли (ω′′) Н2SO4 в приготовленном растворе применим формулу (7.4), выразив массы исходных веществ через объем и плотность
ω′′m′′ = ω′m′ + ωm,

Пример 4. Определить, до какого объема (л) необходимо выпарить 2 л разбавленного раствора сульфата магния с массовой долей МgSO4 2,0 % и плотностью 1,011 г/мл, чтобы приготовить концентрированный раствор с молярной концентрацией 1,1 моль/л.
Решение
Воспользовавшись формулой пересчета массовой доли (ω′) МgSO4 в нормальную концентрацию (см. табл. 7.2), определим СN разбавленного раствора (М(МgSO4) = 120 г/моль; ω = 2 % = 0,02):
![]() моль-экв/л,
или 0,33 н.
моль-экв/л,
или 0,33 н.
Объем концентрированного раствора МgSO4 вычислим из соотношения (7.1). Учтем СN = СМ∙n(MgSO4) = 1,1∙2 = 2,2 моль-экв/л.
СN′∙V′ = CN∙V,
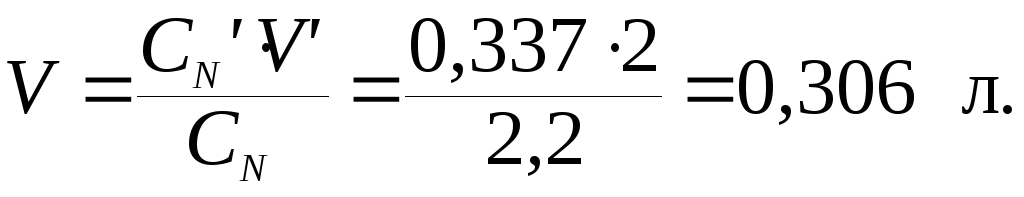
Пример 5. Для нейтрализации 100 мл раствора серной кислоты потребовалось 20 мл 0,5 н раствора гидроксида натрия. Вычислите нормальность раствора Н2SO4 и массу кислоты в этом растворе.
Решение
Согласно закону эквивалентов:
![]()
![]() моль-экв/л,
или
моль-экв/л,
или
0,1 н.
Масса кислоты в растворе составит:
m(H2SO4) = CN(H2SO4) ∙ mЭ(H2SO4) =0,01∙ 49 = 0,49 г.

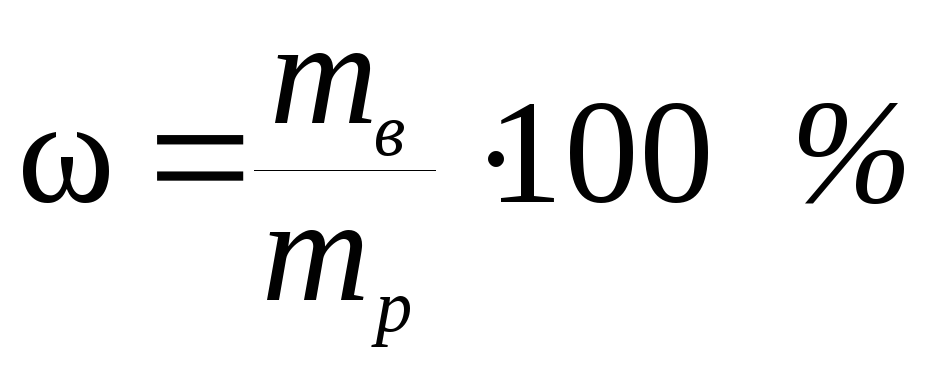
 олярная
доляN
олярная
доляN олярная
концентрация,СМ
олярная
концентрация,СМ